
分析 (1)氯气具有强氧化性,铁在氯气中燃烧生成氯化铁;
(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气;
(3)氯气与水反应生成HCl、HClO,为氧化还原反应;
(4)氯气和石灰乳反应生成氯化钙、次氯酸钙和水.
解答 解:(1)氯气能将金属氧化为最高价,铁在氯气中燃烧的产物是氯化铁,反应为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)氯气与水反应生成HCl、HClO,化学反应方程式为:Cl2+H2O?HCl+HClO,
故答案为:Cl2+H2O?HCl+HClO;
(4)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,该反应为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O.
点评 本题考查的是化学方程式的书写知识,属于化学用语的考查,考查学生根据反应原理书写化学方程式的能力,注意化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
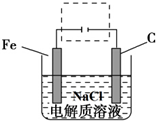 、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 常温常压下,32gO2含有的O原子数为NA | |
| C. | 1mol甲烷的质量与NA个甲烷分子的质量之和相等 | |
| D. | 标准状况下,22.4L 甲烷和乙炔的混合气体所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
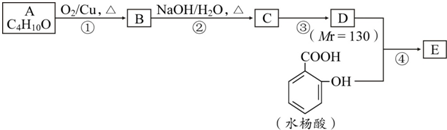

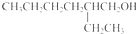 .
.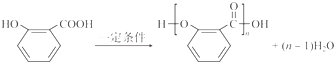 .
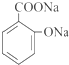
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
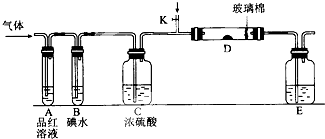 某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质.
某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com