
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
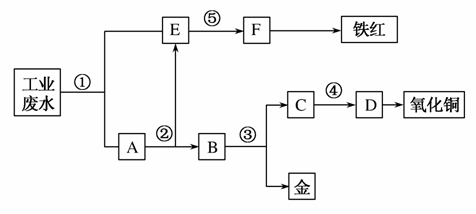
填写下面空白。
(1)图中标号处需加入的相应物质分别是①________;②________;③________;④________;⑤________。
(2)写出①处发生反应的离子方程式_____________________ _____________;写出③处发生反应的化学方程式___________。
(3)铁红的化学式为________________________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________________;氧化铜________________。
答案 (1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+===Fe2++H2↑,2Fe3++Fe===3Fe2+,Cu2++Fe===Cu+Fe2+,2Au3++3Fe===2Au+3Fe2+ 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
解析 本题考查金属分离、提纯。(1)依题意,加入活泼金属将铜、金置换出来。利用金属性质差异,用酸溶、过滤得到被提纯的金属。在废水中加入过量铁粉,过滤得含亚铁离子的滤液和含铜、金、铁单质的滤渣。由铁红逆推F为氢氧化铁,所以,亚铁盐加氢氧化钠溶液制氢氧化亚铁,在空气中氧化生成氢氧化铁。分离铜、铁、金混合物中的金,先用稀硫酸或盐酸溶解铁,过滤得滤渣;再用稀硝酸溶解铜、金混合物,得到金。由氧化铜逆推D为氢氧化铜。
(2)①处加入铁粉,发生四个离子反应。金不溶于硝酸,而铜溶于硝酸,所以,B中加入硝酸,只有铜溶解。(3)铁红成分是氧化铁,工业上主要用作颜料,氧化铜可以制硫酸铜、铜等物质。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
X、Y为两种短周期元素,其原子的最外层电子数分别是1和6,则X、Y两种元素形成的常见化合物或者离子不可能是( )
A.只含极性键的共价化合物
B.含非极性键的共价化合物
C.阴阳离子个数之比为1∶1的离子化合物
D.可形成双核离子或者四核离子
查看答案和解析>>
科目:高中化学 来源: 题型:
醋的主要成分是醋酸,醋在日常生活中有很多妙用。
(1)烹鱼时加入少量食醋和料酒可以使烹制的鱼具有特殊的香味,这种香味来自于________。
A.食盐
B.食醋中的乙酸
C.料酒中的乙醇
D.料酒中的乙醇与食醋中的乙酸反应生成的乙酸乙酯
(2)热水壶用久了会在内壁产生一层水垢,水垢的主要成分是碳酸钙和氢氧化镁,在加热时向壶中倒入白醋,即可除去水垢,写出这一过程中发生反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室要用固体氯化钠准确配制0.5 L 0.2 mol·L-1的NaCl溶液,下列哪种仪器不是必须使用的( )
A.试管 B.胶头滴管
C.500 mL的容量瓶 D.托盘天平
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关蛋白质的叙述正确的是( )
A.蛋白质溶液中加入盐溶液析出沉淀的过程叫盐析
B.蛋白质溶液不能发生丁达尔现象
C.蛋白质溶液中的蛋白质能透过半透膜
D.天然蛋白质的水解产物为α氨基酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com