
| A. | 放热反应一定不需加热就可以进行 | |
| B. | 等物质的量的氢气完全燃烧生成气态水比生成液态水放热多 | |
| C. | 中和热测定时,用铁质材料代替环形玻璃搅拌器,所测中和热数值偏小 | |
| D. | S(g)+O2(g)═SO2 (g);△H1 S(s)+O2(g)═SO2 (g);△H2 △H1>△H2 |
分析 A、有些放热反应也需要一定条件下才能进行;
B、气态水转化为液态水会放出热量;
C、铁是热的良导体,从而影响中和热的测定;
D、固体硫燃烧时要先变为气态硫,过程吸热,据此确定反应热的大小;
解答 解:A、有些放热反应需加热才能发生,如可燃物的燃烧,故A错误;
B、气态水转化为液态水会放出热量,所以氢气燃烧生成气态水放出的热量小于液态水,故B错误;
C、铁是热的良导体,用铁制环形搅拌器搅拌溶液,会导致溶液温度偏低,所以测定的中和热偏低,故C正确;
D、固体硫燃烧时要先变为气态硫,过程吸热,气体与气体反应生成气体比固体和气体反应生成气体产生热量多,但反应热为负值,所以△H1<△H2,故D错误;
故选C.
点评 本题考查了反应能量变化,以及反应中热量大小比较,难度中等,选项D注意盖斯定律的利用,物质的聚集状态不同,反应放出或吸收的热量是不同的.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 方案 |  | 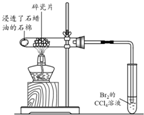 |  | 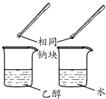 |
| 目的 | 利用乙醇的消去反应制取乙烯 | 验证石蜡油分解的产物是乙烯 | 检验乙烯、乙炔混合气中的乙烯 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 与
与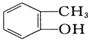
 和
和
 和
和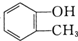
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3跟稀硝酸反应 | B. | Al(OH)3跟稀硝酸反应 | ||
| C. | CuO跟稀硝酸反应 | D. | Fe(OH)2跟稀硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝 | |
| C. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学,使光学显微镜分辨率步入纳米时代.利用此类光学显微镜可以具有丁达尔效应的分散系中分散质 | |
| D. | 酸碱指示剂变色、煤的液化、海水提取溴、焰色反应都涉及化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
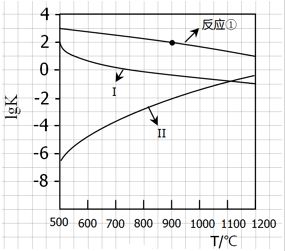 用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.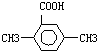 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
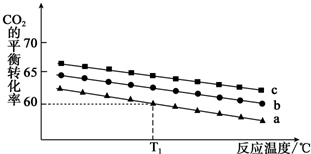
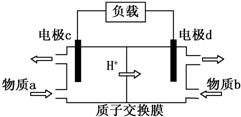
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com