
【题目】获取安全的饮用水成为人们关注的重要问题。回答下列问题:

(1)漂白粉常用于自来水消毒。工业上用氯气和石灰乳制取漂白粉的化学方程式为_________。实验室用MnO2与浓盐酸反应制备Cl2 的反应装置如图所示,制备实验开始时先检查装置气密性,接下来的操作依次是_____________________(填下列序号)。
①往烧瓶中加入浓盐酸 ②加热 ③往烧瓶中加入MnO2粉末
(2)聚铁[Fe2(OH)n(SO4)3-0.5n]m是一种高效无机水处理剂,制备原理是调节Fe2(SO4)3溶液的pH,促进其水解制取。用铁的氧化物制取聚铁的流程如下:
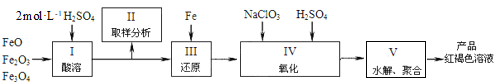
①实验室配制2mol·L-1的稀硫酸250mL需98%的浓硫酸(ρ=1.84g·mL-1)_______mL,配制过程中应使用的玻璃仪器有玻璃棒、烧杯、量筒、________________________。
②步骤Ⅳ中发生反应的离子方程式为_______________。
③步骤Ⅴ中需将溶液加热到70~80 ℃的目的是________________。Ⅴ中溶液的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的方法为_____________;若溶液的pH偏小,将导致聚铁中铁的质量分数__________(填“偏高”、“偏低”或“无影响”)。
(3)硬水易导致产生锅炉水垢[主要成分为CaCO3、Mg(OH)2、CaSO4],不仅会降低燃料的利用率,还会影响锅炉的使用寿命,造成安全隐患,因此要定期清除。清除时首先用饱和Na2CO3溶液浸泡水垢,发生CaSO4(s)+CO32-(aq) ![]() CaCO3(s)+SO42-(aq),该反应的平衡常数K =_______。然后再用醋酸溶解、水洗涤。已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9。
CaCO3(s)+SO42-(aq),该反应的平衡常数K =_______。然后再用醋酸溶解、水洗涤。已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9。
【答案】2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O ③①② 27.2 胶头滴管、250mL容量瓶 6Fe2+ + ClO3- + 6H+ = 6Fe3+ + Cl- + 3H2O 促进Fe3+水解 将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后跟标准比色卡对比 偏低 2.5×104
【解析】
(1)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,据此书写;加药顺序一般是先加入固体药品,再加入液体药品,最后再加热;
(2)根据流程:用稀硫酸溶解铁的氧化物得到硫酸亚铁、硫酸铁,取样,加入Fe还原得到硫酸亚铁溶液,再加入氯酸钠、稀硫酸氧化,得到Fe2(SO4)3溶液,调节pH促进其水解得到产品;
①密度为1.84gcm-3、98%的浓硫酸的物质的量浓度=(1000×1.84×98% /98)mol/L
=18.4mol/L,2molL-1的稀硫酸250mL的n(H2SO4)=0.5mol,据此计算;
②步骤Ⅳ中亚铁离子在酸性条件下被氯酸钠氧化生成铁离子氯酸根被还原成氯离子,据此书写;
③温度升高有利于水解;酸性较强,会使得聚铁中氢氧根偏少,硫酸根偏多,据此解答。
(1)据分析工业上用氯气和石灰乳制取漂白粉的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+H2O;实验室用MnO2与浓盐酸反应制备Cl2的反应装置如图所示,制备实验开始时先检查装置气密性,加药品先加入固体,再加入液体浓盐酸,最后加热,顺序为③①②;
(2)①密度为1.84gcm-3、98%的浓硫酸的物质的量浓度=(1000×1.84×98% /98)mol/L
=18.4mol/L,2molL-1的稀硫酸250mL的n(H2SO4)=0.5mol,需要浓硫酸的体积=0.5mol/(18.4mol/L)=27.2mL;配制250mL一定物质的量浓度溶液应使用的玻璃仪器有玻璃棒、烧杯、量筒、250mL容量瓶、胶头滴管;
②步骤Ⅳ中发生反应,亚铁离子在酸性条件下被氯酸钠氧化生成铁离子、氯酸钠中氯元素被还原成氯离子,反应为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
③步骤V中需将溶液加热到70~80℃的目的是促进Fe3+水解;pH试纸测定溶液pH的方法为将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后跟标准比色卡对比;若溶液的pH偏小,酸性较强,会使得聚铁中氢氧根偏少,硫酸根偏多,因而铁的质量分数偏低;
(3)已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9,CaSO4(s)+CO32-(aq)CaCO3(s)+SO42-(aq),![]() 。
。
。


科目:高中化学 来源: 题型:
【题目】科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法不正确的是
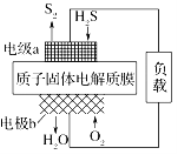
A. 电极a为电池的负极
B. 电极b上发生的电极反应为O2+4H++4e-===2H2O
C. 电路中每流过4 mol电子,在正极消耗44.8 L H2S
D. 每0.5molH2S参与反应,有1 mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行相应实验,能达到实验目的的是( )
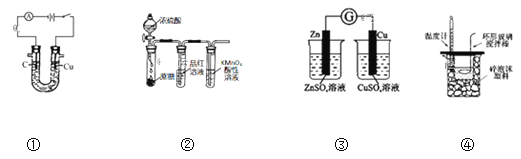
A.图①所示装置可电解食盐水制氯气和氢气
B.图②所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
C.图③装置可以用来验证化学能转化为电能
D.图④测定中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1NaOH溶液分别滴定20.00mL0.1molL-1的盐酸和苯甲酸溶液,滴定曲线如下图所示,下列说法正确的是

A.图Ⅰ、图Ⅱ分别是NaOH溶液滴定苯甲酸、盐酸的曲线
B.V(NaOH)=10.00mL时,滴定苯甲酸的混合溶液中c(C6H5COO-)> c(Na+)> c(H+)>c(OH-)
C.滴定苯甲酸溶液时最好选用甲基橙作指示剂
D.达到B、D状态时,NaOH溶液分别与盐酸、苯甲酸恰好发生中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是门捷列夫发现元素周期律150周年。某学习小组同学为探究同周期或同主族元素性质的递变规律,分别设计了如下实验:
Ⅰ.将少量等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:
【1】上述金属中与盐酸反应最剧烈_____。
A.钾B.钠C.镁D.铝
【2】上述金属中与盐酸反应生成相同条件下的气体最多_____。
A.钾B.钠C.镁D.铝
Ⅱ.利用图装置来验证同主族元素非金属性的变化规律:
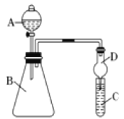
现要证明非金属性:Cl>I。在A中加浓盐酸,C中加淀粉碘化钾混合溶液,B中加某试剂。
常温下,通过合理操作,观察到C中溶液变蓝的现象,即可证明。
请结合装置回答下列问题:
【3】B中可加入_____
A.MnO2固体B.KMnO4固体C.浓H2SO4D.大理石
【4】仪器A的名称是_____
A.普通漏斗B.长颈漏斗C.分液漏斗D.容量瓶
【5】从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用 吸收尾气。
A.澄清石灰水B.KBr溶液C.浓H2SO4D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以闪锌矿(主要成分ZnS,含Fe、Cu、Cd等元素的杂质)为原料,通过火法或湿法炼锌,两种方法都是先将闪锌矿焙烧得到以ZnO为主要成分的焙砂,再分别制得锌。具体流程如下:
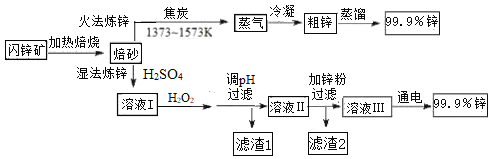
已知:
Fe3+ | Zn2+ | Cu2+ | Fe2+ | Cd2+ | |
开始沉淀的pH | 1.1 | 5.9 | 4.7 | 7.6 | 6.9 |
沉淀完全的pH | 3.2 | 8.1 | 6.7 | 9.6 | 9.7 |
(1)火法炼锌涉及的主要反应:
2C(s) + O2(g) = 2CO(g) H=﹣220 kJ· mol-1
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) H=﹣930 kJ· mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) H= +198 kJ· mol-1
则ZnS(s) + 2O2(g) + C(s) = Zn(g) +CO2(g) + SO2(g) 的H=_______________。
(2)湿法炼锌工艺中加入双氧水的目的是____________,调节pH的范围是________,滤渣1的成分是___________(写化学式),滤渣2的成分是___________(写化学式)。
(3)含锌废液是造成环境污染的重要原因之一。
①已知氢氧化锌和氢氧化铝性质相似。向电解后废液中加入稍过量的KOH溶液(假设其他物质不与碱反应),发生反应的离子方程式是_______________。
②一种生产锌的新技术碱浸—电解法的原理是:将ZnO溶于KOH溶液得到四羟基合锌酸钾[K2Zn(OH)4]溶液,再电解该溶液即获得金属锌。用石墨电极电解时阴极的反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种高品质的磷矿石——鸟粪石的化学式为MgNH4PO4,下列关于该物质的结构和性质的推测中不合理的是( )
A.鸟粪石既属于镁盐又属于磷酸盐
B.鸟粪石既能和强酸反应又能和强碱反应
C.鸟粪石中既含有离子键又含有共价键
D.鸟粪石中两种阳离子的电子式分别为[··![]() ··]2+、[H··
··]2+、[H··![]() ··H]+
··H]+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1mol·L-1KOH溶液中滴加0.1 mol·L -1HA(弱酸)溶液,混合溶液中水电离出的c(OH-)与HA溶液体积之间的关系如图I所示:向20.00mL0.1 mol ·L-1 HA溶液中滴加0. 1mol ·L-1 KOH溶液,混合溶液中水电离出的c(OH-)与KOH溶液体积之间的关系如图II所示。

下列有关说法正确的是
A. A点、X点对应溶液中水的电离程度相同
B. B点、Y点对应溶液的pH相等
C. C点、Z点对应溶液中都存在:c(OH-)=c(H+)+c(HA)
D. D点、W点对应溶液中分别都存在:c(K+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH1 ②CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2 下列推断正确的是( )
A.若CO的燃烧热为ΔH3,则H2的燃烧热为ΔH3-ΔH1
B.反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=ΔH1-ΔH2
C.若反应②的反应物总能量低于生成物总能量,则ΔH2<0
D.若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则ΔH1<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com