
 为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.
为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.分析 (1)①已知C(s)+H2O(g)═CO(g)+H2(g)△H1=+131.3kJ•mol-1
C(s)+2H2O(g)═CO2(g)+2H2(g)△H2=+90kJ•mol-1
由盖斯定律可知,①-②得到CO(g)+H2O(g)═CO2(g)+H2(g);
(2)①K为生成物浓度幂之积与反应物浓度幂之积的比;
②K只与温度有关;
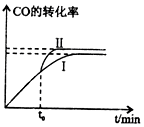
(3)在t0时刻改变一个条件,曲线I变为曲线Ⅱ,达到平衡的时间减少,CO的转化率增大,结合平衡移动及速率影响因素来解答.
解答 解:(1)①已知C(s)+H2O(g)═CO(g)+H2(g)△H1=+131.3kJ•mol-1
C(s)+2H2O(g)═CO2(g)+2H2(g)△H2=+90kJ•mol-1
由盖斯定律可知,①-②得到CO(g)+H2O(g)═CO2(g)+H2(g)△H=(+131.3kJ•mol-1)-(+90kJ•mol-1)=+41kJ/mol,
即热化学方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=+41kJ/mol,
故答案为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=+41kJ/mol;
(2)①K为生成物浓度幂之积与反应物浓度幂之积的比,由反应可知K=$\frac{c(C{H}_{3}OC{H}_{3}){c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$,故答案为:$\frac{c(C{H}_{3}OC{H}_{3}){c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$;
②K只与温度有关,若温度不变,减小反应投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],则K将不变,故答案为:不变;
(3)在t0时刻改变一个条件,曲线I变为曲线Ⅱ,达到平衡的时间减少,CO的转化率增大,则
A.升高温度,速率加快,为放热反应,则平衡逆向移动,CO转化率减小,故A不选;
B.加入催化剂,平衡不移动,故B不选;
C.缩小容器体积,反应速率加快,该反应为气体体积减小的反应,则平衡正向移动,CO转化率增大,故C选;
D.增加H2的浓度,反应速率加快,平衡正向移动,CO转化率增大,故D选;
E.分离出二甲醚,平衡正向移动,CO转化率增大,但反应速率减小,故E不选;
故答案为:CD.
点评 本题考查化学平衡的计算,为高频考点,把握盖斯定律应用、K的表达式及影响因素、平衡移动为解答的关键,侧重分析与应用能力的考查,注意(3)中图象与平衡移动原理的结合,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
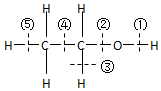
| A. | 和金属钠反应是键①断裂 | B. | 和浓硫酸共热到170℃时断键②和⑤ | ||
| C. | 和浓硫酸共热到140℃时仅断键② | D. | 和浓氢溴酸混合加热时断键② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用小苏打 (NaHCO3)治疗胃酸过多:HCO3-+H+═H2O+CO2↑ | |
| C. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸能产生无色气体,则一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有Ag+ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | t1时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂 | |
| B. | 反应达到平衡时,外界条件对平衡影响关系如图所示,若b=1,a为正整数,则P1<P2 | |
| C. | 从加入反应物开始,物质的百分含量与温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A、B一定是气体,D一定不是气体,C可能不是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L水中含有的分子数约为0.l NA | |
| B. | 在常温常压下,1 mol He含有的原子数为NA | |
| C. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| D. | 物质的量浓度为0.5mol/L FeCl3溶液中Cl-的数目为1.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com