
| A�� | ����ˮբ����������������ӵ�����������������ֹ������ʴ | |
| B�� | ��ӦSO2��g��+2H2S��g��=3S��S��+2H2O��l���ڳ��������Է����У���÷�Ӧ�ġ�H��0 | |
| C�� | 0.1mol•L-1��CH3COOH��Һ��ˮϡ�ͣ���Һ��pH����Һ��ˮ�ĵ���̶Ⱦ����� | |
| D�� | �����£���������������ʵ���Ũ�ȵ�NaHCO3��NaCl��Һ��ϣ���������NaHCO3���壬���ˣ�������ҺpH��7������KW/c��H+����1.0��10-7 mol•L-1 |
���� A����������������ӵ��������������������ֱ�Ϊ������������
B����H-T��S��0�ķ�Ӧ�ܹ��Է����У�
C�������ˮϡ�ͣ���Һ���Լ������ٽ�����ĵ���ƽ�������ƶ���
D�������£���ҺpH��7��c��H+����1.0��10-7 mol•L-1��
��� �⣺A����������������ӵ��������������������ֱ�Ϊ��������������������ԭ��Ӧ���ɷ�ֹ����������A��ȷ��
B���÷�Ӧ��S��0������Ӧ�ܹ��Է����С�H����С��0����B��ȷ��
C�������ˮϡ�ͣ���Һ���Լ������ٽ�����ĵ���ƽ�������ƶ���������Һ��pH����Һ��ˮ�ĵ���̶Ⱦ�����C��ȷ��
D�������£���ҺpH��7��c��H+����1.0��10-7 mol•L-1��c��OH-��=$\frac{{K}_{W}}{c��{H}^{+}��}$��1.0��10-7 mol•L-1����D����
��ѡD��
���� ���⿼���˽����ĵ绯ѧ��������Ӧ�Է����е�������������ʵĵ���ƽ���Լ���ˮ�����ӻ������ļ��㣬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ժ������ԣ���ԭ�� | B�� | �����ԡ������Ժͻ�ԭ�� | ||
| C�� | �����ԡ���ԭ�ԣ��������� | D�� | �������Ժͻ�ԭ�ԣ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
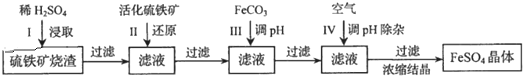
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ȵķ�Ӧ����ʱ���ؼ��� | |
| B�� | ��ѧ��Ӧһ���������仯 | |
| C�� | ���ȷ�Ӧһ����Ҫ���Ⱥ���ܷ��� | |
| D�� | ��ѧ��Ӧ��ЧӦ��ֵ�뷴Ӧ���ʶ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����� | Ԥ������ | �� �� | |
| ��֤����� | ����٣�ȡ����0.01mol/L ����KMnO4��Һ������������Һ�� | ��Һ�Ϻ�ɫ��ȥ | ����Fe2+ |
| ����ڣ���ȡ����������Һ���μ�KI��Һ�͵�����Һ | ��Һ��Ϊ��ɫ | ����Fe3+ | |
| ��֤����� | ����������ͨ������װ�� | ����KMnO4��Һ��ɫ������KMnO4��Һ��ɫ���䣬�Թ����ռ������� | �������ֻ��������� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
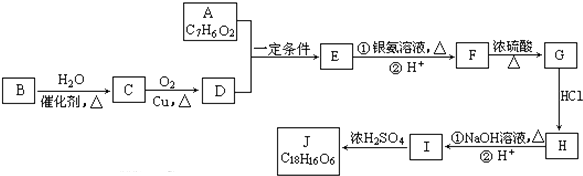
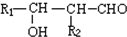
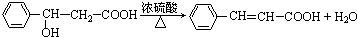 ��
��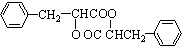 ��
��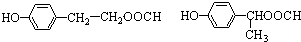 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧʽ | CH3COOH | H2CO3 | HClO |
| ����ƽ�ⳣ��K1 | 1.8��10-5 | 4.3��10-7 | 3.0��10-8 |
| K2 | -- | 5.6��10-11 | -- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com