
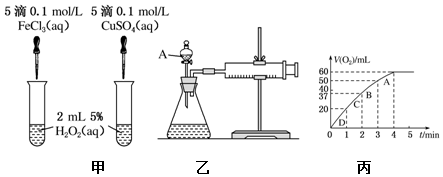
分析 (1)比较金属阳离子的催化效果要排斥阴离子的干扰;
(2)收集的气体的体积相同,若比较反应速率快慢,需要知道生成40mL气体所需的时间;
(3)①根据图象确定生成氧气的体积;
②根据图象确定反应需要的时间;
③单位时间内产生氧气体积的多少就能代表反应速率的大小;
④物质的浓度与反应速率成正比,浓度减小,反应速率减小.
解答 解:(1)如图甲可通过观察产生气泡的快慢,定性比较得出催化剂的催化效果,产生气泡快的催化效果好,但只能比较氯化铁和硫酸铜的催化效果,因二者所含的阴离子不同,要证明Fe3+比Cu2+对H2O2分解催化效果好,还要使选择的试剂中阴离子种类相同,所以得出Fe3+和Cu2+对H2O2分解的催化效果,是不合理的,
故答案为:不合理; 阴离子种类不同;
(2)如果比较反应速率快慢,则实验中需要测量的数据为:产生40mL气体所需的时间,反应时间越短,则反应速率越快,
故答案为:产生40mL气体所需的时间;
(3)①根据图象知,第4分钟时,随着时间的推移,气体体积不变,所以实验时放出气体的总体积是60 mL,故答案为:60;
②放出 $\frac{1}{3}$气体体积是60 mL×$\frac{1}{2}$=20mL,根据图象知,需要的时间是1min,故答案为:1;
③单位时间内产生氧气体积的多少就能代表反应速率的大小,根据图象结合v=$\frac{V({O}_{2})}{t}$可知,A、B、C、D各点反应速率快慢的顺序为:D>C>B>A,说明随着反应的进行,反应速率逐渐降低,
故答案为:D;C;B;A;
④反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小,
故答案为:随着反应的进行,浓度减小,反应速率减慢.
点评 本题考查探究催化剂、浓度等对反应速率的影响的实验方案设计,试题灵活,根据v=$\frac{△c}{△t}$来设计实验,通过得到气体的体积和时间的关系确定影响反应速率的因素,题目难度中等.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
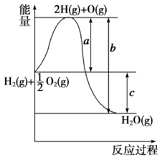 已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,则:
已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,则:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,每生成1mol SO42-,可脱去2mol Cl2 | |
| B. | 该反应中氧化剂是Cl2,反应消耗的氧化剂与还原剂之比为4:1 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | SO2也有漂白性,将SO2与氯气混合后使用,漂白性会增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、Cu2+、Sb3+ | B. | Cu2+、Ag+、Sb3+ | C. | Sb3+、Ag+、Cu2+ | D. | Ag+、Sb3+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
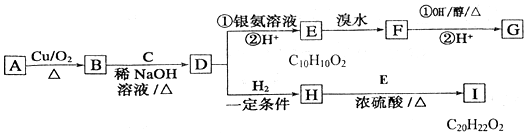
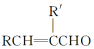 +H2O
+H2O ;E中含氧官能团的名称:羧基.
;E中含氧官能团的名称:羧基. +
+ $→_{加热}^{浓硫酸}$
$→_{加热}^{浓硫酸}$ +H2O.
+H2O.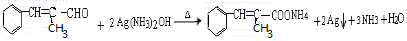 .
. .
.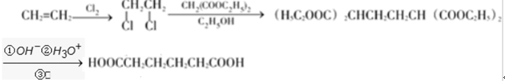 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com