
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| D. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
分析 A、醋酸是弱电解质,加水促进其电离;
B、判断强酸、弱酸的依据是该酸是否完全电离,NaHA溶液的pH>7说明H2A的二级电离,不完全电离,即HA-为弱酸,可以说明H2A是弱酸,NaHA溶液的pH<7,H2A是强酸或弱酸都有可能;
C、NaOH滴定HCl与CH3COOH,醋酸是弱电解质,若碱与酸恰好反应,溶液中溶质为氯化钠、醋酸钠,醋酸根水解溶液呈碱性,反应呈中性,溶液中的酸有剩余;
D、在含有BaSO4沉淀的溶液中加入Na2SO4固体,Ksp(BaSO4)不变.
解答 解:A、稀释醋酸时能促进弱电解质醋酸的电离,导致稀释后溶液中氢离子浓度大于原来的$\frac{1}{10}$,稀释后溶液的3<pH<4,故A错误;
B、NaHA溶液的pH>7说明H2A的二级电离,不完全电离,即HA-为弱酸,可以说明H2A是弱酸,NaHA溶液的pH<7,H2A是强酸或弱酸都有可能,如硫酸、亚硫酸,故B错误;
C、NaOH滴定HCl与CH3COOH,醋酸是弱电解质,若碱与酸恰好反应,溶液中溶质为氯化钠、醋酸钠,醋酸根水解溶液呈碱性,反应呈中性,溶液中的酸有剩余,故C正确;
D、在含有BaSO4沉淀的溶液中加入Na2SO4固体,Ksp(BaSO4)不变,而c(SO42-)增大,故c(Ba2+)减小,故D错误.
故选C.
点评 考查强弱电解质、弱电解质的电离、盐类水解、溶度积及相关计算等,难度中等,注意把握强弱电解质关键是电解质是否完全电离.


科目:高中化学 来源: 题型:选择题
| A. | 都正确 | B. | .①②③ | C. | .②③④ | D. | .①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻二溴苯只有一种可以证明苯环结构中不存在单双键交替结构 | |
| B. | 可以用分液漏斗分离苯和硝基苯 | |
| C. | 制取一氯乙烷的最佳途径是通过乙烷与氯气反应获得 | |
| D. | 等物质的量的乙醇和水分别与足量的钠反应,生成的气体体积比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
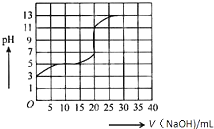 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )| A. | 该弱酸在滴定前的浓度大于0.001mol/L | |
| B. | 由滴定起点数据可计算该弱酸的Ka(电离平衡常数)为2×10-5 | |
| C. | 滴定过程为求滴定终点,最合适的指示剂是酚酞 | |
| D. | 滴定终点时,c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率 | |
| B. | 使用恰当的催化剂能加快反应速率 | |
| C. | 增大N2的浓度能加快反应速率 | |
| D. | 平衡时各组分含量之比一定等于3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
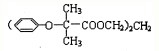 .已知:
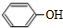
.已知: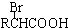 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$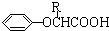
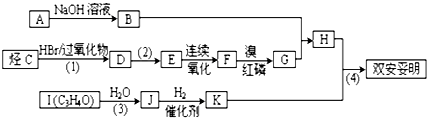
 ,JHOCH2CH2CHO,C化学名称2-甲基-1-丙烯.
,JHOCH2CH2CHO,C化学名称2-甲基-1-丙烯.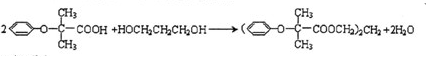 .
.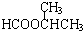 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取20.00 g NaOH固体 | |
| B. | 向用水润湿的pH试纸上滴盐酸,可测定盐酸的pH | |
| C. | 用电子分析天平测得铁片质量是15.524 g | |
| D. | 在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,此时再加入蒸馏水使其液面与刻度线持平 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com