
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3•H2O+H2O | |
| B. | 在100 mL浓度为1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 硫化钠的水解:S2-+H2O?HS-+OH- | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨作电极电解氯化镁溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$-H2↑+Cl2↑+2OH- | |
| B. | 用过量氨水吸收工业尾气中的SO2:2NH3•H20+SO2=2NH4++SO32-+H2O | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥⑦ | B. | ①②③④⑤⑥ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 水解:Al3++3H2O═Al(OH)3 +3H+ | |
| B. | NaHCO3 电离:NaHCO3 ?Na++HCO3- | |
| C. | 固体Ca(OH)2 与NH4Cl共热:NH4++OH-═NH3+H2O | |
| D. | 过量的CO2 气体通入饱和石灰水中:CO2 +OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.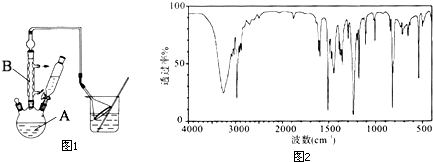
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:2 | D和E 1:3 | B和E 1:4 |
 .B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
.B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Cu2+、C1-、NO3- | B. | Ca2+、Al3+、Br-、ClO- | ||
| C. | NH4+、K+、HSO3-、CO32- | D. | Na+、K+、MnO4-、I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com