
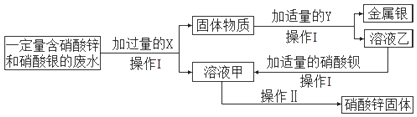
分析 由流程图分析,加入的X是过量的锌,过滤后,固体物质是锌和银的混合物,加入稀硫酸将其分离,溶液乙就是硫酸锌溶液;硫酸锌与硝酸钡反应生成硫酸钡白色沉淀和硝酸锌;操作Ⅱ是从溶液中获取晶体,是蒸发结晶,玻璃棒在此过程中的作用是搅拌散热;据此分析.
解答 解:①由流程图分析,加入的X是过量的锌,过滤后,固体物质是锌和银的混合物,加入稀硫酸将其分离,溶液乙就是硫酸锌溶液;硫酸锌与硝酸钡反应生成硫酸钡白色沉淀和硝酸锌,反应的方程式为:ZnSO4+Ba(NO3)2=BaSO4↓+Zn(NO3)2,
故答案为:锌(或Zn);ZnSO4+Ba(NO3)2=BaSO4↓+Zn(NO3)2;
②操作I是将固体和液体的分离,是过滤;操作Ⅱ是从溶液中获取晶体,是蒸发结晶,都需要玻璃棒,在蒸发中玻璃棒的作用是因局部温度过高造成液滴飞溅;
故答案为:过滤;蒸发时用玻璃棒不断搅拌,防止因局部温度过高造成液滴飞溅.
点评 本题考查了废液的处理,依据在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来进行设计分析实验,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1molN2和3molH2混合发生反应,转移的电子总数为6NA | |
| B. | 1L0.1mol•L-1的Na2CO3溶液中阴离子的总数大于0.1NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有2molFe2+被氧化时,消耗Cl2的分子数为NA | |
| D. | 1mol-CH3中所含的电子总数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热、通氢气、停止加热、继续通氢气至试管冷却 | |
| B. | 通氢气、加热、停止加热、继续通氢气至试管冷却 | |
| C. | 通氢气后立即点燃酒精灯加热 | |
| D. | 停止加热后立即停止通氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠水溶液在电流的作用下电离出Na+和Cl- | |
| B. | 二氧化碳的水溶液能够导电,故二氧化碳属于电解质 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于电解质 | |
| D. | 氧化钠在水中的电离方程式可表示为Na2O=2Na++O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Al2O3+3C$\frac{\underline{\;高温\;}}{\;}$4Al+3CO2↑ | B. | CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑ | ||
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | D. | 2HgO$\frac{\underline{\;电解\;}}{\;}$2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
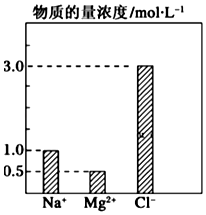 在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
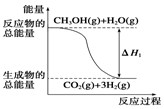 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:| A. | 1 mol CH3OH完全燃烧放出192.9 kJ热量 | |
| B. | 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程不一定要吸收能量 | |
| D. | 根据②推知:CH3OH(1)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H<-192.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Mg2+ | C. | Cl- | D. | Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com