
| A. | 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- | |
| C. | 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| D. | 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为CO32-+2H+=CO2↑+H2O |
分析 A、若X、Y的物质的量之比为1:4,且N是黄绿色气体即氯气,则该反应为实验室制氯气的反应;
B、能使澄清石灰水变浑浊的气体有二氧化碳、二氧化硫,二氧化硫具有强还原性能与溴水发生氧化还原反应;
C、若X是铁,Y是稀硝酸(过量),过量的稀硝酸可以将金属铁氧化到最高价,稀硝酸对应的还原产物是NO;
D、碳酸钠、碳酸氢钠均可以和盐酸反应生成二氧化碳和水.
解答 解:A、若X、Y的物质的量之比为1:4,且N是黄绿色气体即氯气,则该反应为实验室制氯气的反应,该反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故A正确;
B、能使澄清石灰水变浑浊的气体有二氧化碳、二氧化硫,二氧化硫具有强还原性能与溴水发生氧化还原反应,所以则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,故B正确;
C、若X是铁,Y是稀硝酸(过量),过量的稀硝酸可以将金属铁氧化到最高价,稀硝酸对应的还原产物是NO,则金属铁和过量的硝酸反应的离子方程式为:Fe+4H++NO3-═Fe3++NO↑+2H2O,故C正确;
D、氯化钠为氯碱工业的主要原料,二氧化碳是造成温室效应的主要气体之一,则碳酸钠、碳酸氢钠均可以和盐酸反应生成氯化钠、二氧化碳和水,所以该离子方程式可能为CO32-+2H+=CO2↑+H2O或者HCO3-+H+=CO2↑+H2O,故D错误;
故选:D.
点评 本题是一道关于元素以及化合物之间的性质和转化知识的考题,综合性较强,难度大.


科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池充电时,阳极固体质量增大 | |
| B. | 0.1mol•L-1CH3COONa溶液加热后,溶液的pH减小 | |
| C. | 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023个 | |
| D. | 室温下,稀释0.1mol•L-1氨水c(H+).c(NH3•H2O)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 预测的实验现象 | 实验结论或解释 | |
| A | 向饱和Na2CO3 溶液中滴加少量稀盐酸 | 立即有气体逸出 | CO32-+2H+═H2O+CO2↑ |
| B | 将浓硫酸滴加到盛有铜片的试管中,并将 蘸有品红溶液的试纸置于试管口 | 品红试纸褪色 | SO2具有漂白性 |
| C | 铝箔在酒精灯火焰上加热 | 铝熔化但不会滴下 | A12O3的熔点比铝高 |
| D | 向淀粉的酸性水解液中滴入少量新制 Cu (OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是负极,发生还原反应 | |
| B. | O2在正极发生氧化反应 | |
| C. | 工作一段时间后,电解质溶液的碱性会减弱 | |
| D. | 该电池能将化学能全部转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
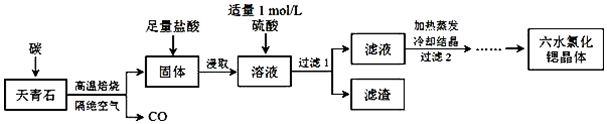
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
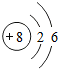 ,b的最简单氢化物的电子式为
,b的最简单氢化物的电子式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com