
| A. | ④ | B. | ① | C. | ③ | D. | ② |
科目:高中化学 来源: 题型:选择题
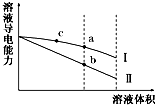 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )| A. | 两溶液稀释前的浓度相同 | |
| B. | a、b、c三点溶液的pH由大到小顺序为a>b>c | |
| C. | a点的KW值比b点的KW值大 | |
| D. | a点水电离的c(H+)大于c点水电离的c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
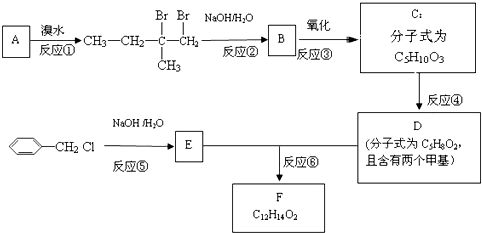
 .
.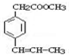 是F的一种同分异构体,属于芳香族化合物
是F的一种同分异构体,属于芳香族化合物查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | c(NH+4)相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,pH大小:①>②>③ | |
| B. | 0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 25℃时,pH=2的CH3COOH与pH=12的NaOH溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑥ | C. | ①②③ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
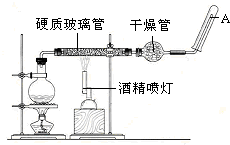 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,就可以完成高温下“Fe与水蒸气的反应实验”.请设计实验,证明还原铁粉与水蒸气能够发生反应.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,就可以完成高温下“Fe与水蒸气的反应实验”.请设计实验,证明还原铁粉与水蒸气能够发生反应.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
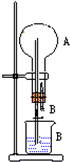 在图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶.
在图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶.| A | B | 喷泉颜色 | |
| 途经1 | |||
| 途经2 | |||
| 途经3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2Y3 | B. | XY3 | C. | X2Y2 | D. | X3Y2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com