
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,1.06g Na2CO3含有的Na+离子数目为0.02 NA
B.常温常压下,2NA个CO2分子占有的体积为44.8L
C.标准状况下,22.4LH2O含有的分子数为 NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L四氯化碳中含有共价键总数为0.4NA
B.46g NO2和N2O4的混合气体中,含有的氮原子数为1NA
C.1L1.0mol/L的盐酸中含有HCl分子数为NA
D.一定条件下,将2molSO2与1molO2充分反应,得到SO3的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸(M)是医药、香料的中间体,实验室由芳香化合物A制备M的一种合成路线如下:
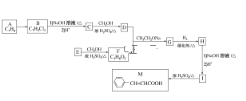
已知:①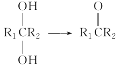 (R1、R2表示氢原子或烃基)
(R1、R2表示氢原子或烃基)
②R1COOR2+R3CH2COOR4![]()
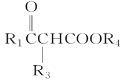 +R2OH
+R2OH
(R1、R3表示氢原子或烃基,R2、R4表示烃基)
请回答下列问题:(1)A→B的条件为________。
(2)E中所含官能团的名称为________。
(3)H的结构简式为________。(4)I→M的反应类型为________。
(5)D+F→G的化学方程式为________________________。
(6)同时满足下列条件的I的同分异构体有________种(不考虑立体异构),任写一种核磁共振氢谱中有6组吸收峰且峰面积之比为1:2:2:2:2:1的结构简式为_______。
①能发生显色反应和银镜反应 ②苯环上连有两个取代基
(7)参照上述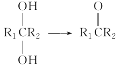 信息,以甲烷和苯酚为原料(其他无机试剂任选),设计制备
信息,以甲烷和苯酚为原料(其他无机试剂任选),设计制备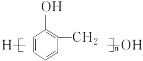 的合成路线_______________________。
的合成路线_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油化学工业最重要的基础原料,经乙烯为原料可以制得许多工业材料和日用品。乙烯能发生下列转化关系:
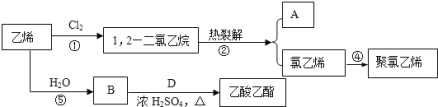
(1)A的分子式为____________,化合物D的官能团名称是_____________。
(2)写出反应①、④的化学方程式:
①__________;
④__________。
(3)上述反应中,以生成有机产物为目标,原子利用率100%的反应有_________________。
(4)实验室用B与D制备乙酸乙酯的化学方程式是______,浓硫酸的作用是_______ ,分离提纯产品所用的试剂是________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )
2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )
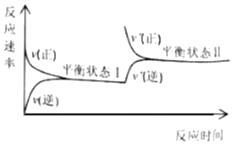
A.平衡状态Ⅱ时的c(H2)一定小B.平衡状态Ⅱ时的c(NH3)一定大
C.平衡常数K一样大D.平衡状态Ⅱ时的v(正)一定大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期VA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。
完成下列填空:
(1)砷原子核外有__个电子层,最外层有__个电子,写出砷原子最外层电子的轨道表示式:__。
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:__(用元素符号表示)。
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:__强于__(填物质的化学式)。
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:__。
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
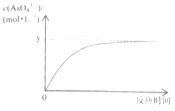
①写出该反应平衡常数的表达式K=___。
②不能判断反应达到平衡状态的是___(选填编号)。
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25 g/mL、质量分数为36.5%的浓盐酸配制240 mL 0.1 mol/L的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为_________。
(2)配制 240 mL 0.1mol/L的盐酸。
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
______ | ______ |
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次 )_________
A. 用30 mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B. 用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C. 将已冷却的盐酸沿玻璃棒注入容量瓶中
D. 将容量瓶盖紧,振荡,摇匀
E. 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F. 继续往容量瓶内小心加水,直到液面接近刻度线12 cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤_________。
②容量瓶中原有少量蒸馏水_________。
③定容时观察液面俯视_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在273K和101kPa的条件下,将2.00g氦气,1.40g氮气和1.60g氧气混合,求:
(1)该混合气体的总物质的量为______________
(2)该混合气体的体积是_______________
(3)该混合气体的平均摩尔质量为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向VmL0.1mol/L氨水中滴加等物质的量浓度的稀H2SO4,测得混合溶液的温度和pOH[pOH=-lgc(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化),下列说法不正确的是( )
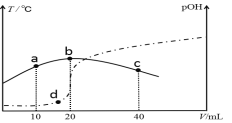
A. a、b、c三点由水电离的c(H+)依次减小
B. V=40
C. b点时溶液的pOH>pH
D. a、b、d三点对应NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com