
 有A、B、C、D、E五种元素,其中A元素的一种核素没有中子,B元素的电负性最大,C元素的基态原子L层上有三个未成对电子,D元素为主族元素且与E元素同周期,其最外电子层上只有两个运动状态不同的电子,E元素有两种常见氧化物E2O、EO,其中E2O为砖红色.请回答:
有A、B、C、D、E五种元素,其中A元素的一种核素没有中子,B元素的电负性最大,C元素的基态原子L层上有三个未成对电子,D元素为主族元素且与E元素同周期,其最外电子层上只有两个运动状态不同的电子,E元素有两种常见氧化物E2O、EO,其中E2O为砖红色.请回答:分析 A元素的一种核素没有中子,则A为H元素;B是电负性最大的元素,则为F元素;C元素的基态原子L层上有三个未成对电子,C最外层含有5个电子,原子序数为7,是N元素;E元素有两种常见氧化物E2O、EO,其中E2O为砖红色,E2O为Cu2O,则E为Cu元素;D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子,说明其最外层上有两个电子,则E为Ca元素,据此进行解答.
解答 解:A元素的一种核素没有中子,则A为H元素;B是电负性最大的元素,则为F元素;C元素的基态原子L层上有三个未成对电子,C最外层含有5个电子,原子序数为7,是N元素;E元素有两种常见氧化物E2O、EO,其中E2O为砖红色,E2O为Cu2O,则E为Cu元素;D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子,说明其最外层上有两个电子,则E为Ca元素,
(1)C2分子为N2,氮气分子中存在氮氮三键,三键中含有1个δ键和2个π键
故答案为:1;2;
(2)A元素简单氧化物为H2O,H2O分子每个O原子含有2个共价单键和2个孤电子对,所以O原子采用sp3杂化,
故答案为:sp3;
(3)C3-离子与CO2分子互为等电子体,二氧化碳为直线型结构,则C3-离子空间构型为直线型,
故答案为:直线型;
(4)Cu为29号元素,原子核外电子数为29,其中3d能级达到全满,简化电子排布式为[Ar]3d104s1,则其价电子排布式为:3d104s1,
故答案为:3d104s1;
(5)A、C、E元素的原子可以形成Cu(NH3)42+配离子,Cu(NH3)42+中Cu原子和N原子之间存在配位键、N-H原子之间存在极性键,
故答案为:bd;
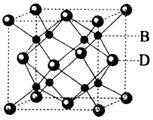
(6)根据图片知,每个D原子连接8个B原子,所以D原子配位数是8,
故答案为:8;
(7)CA3分子为NH3,氨气和水分子都为极性分子,符合相似相溶原理,且氨气和水之间可以形成氢键,所以在水中的溶解度很大,
故答案为:二者都为极性分子,符合相似相溶原理,且氨气和水之间可以形成氢键.
点评 本题考查较为综合,涉及晶胞计算、位置、结构与性质关系的综合应用等知识,推断元素为解答关键,注意掌握常见晶胞结构与判断方法,试题培养了学生的分析能力及灵活应用能力.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:填空题
 与NaOH水溶液共热,生成的有机物的结构简式为
与NaOH水溶液共热,生成的有机物的结构简式为 .
. ;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为
;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀时的pH | 沉淀完全时的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
| 物质 | 20℃时溶解性(H2O) |
| CaSO4 | 微溶 |
| NiF | 可溶 |
| CaF | 难溶 |
| NiCO3 | Ksp=1.0×10-6 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| B | 向浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
| C | 取少量淀粉水解液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,出现砖红色沉淀 | 淀粉已完全水解 |
| D | 在CuSO4溶液中加入KI溶液,再加入苯,振荡,有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(正)减小,v(逆)增大 | B. | v(正)增大,v(逆)减小 | C. | v(正)、v(逆)都减小 | D. | v(正)、v(逆)都增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com