
【题目】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
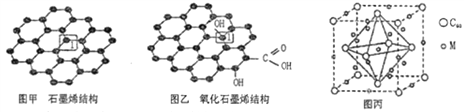
(1)图甲中,1号C与相邻C形成σ键的个数为__________。
(2)图乙中,1号C的杂化方式是__________,该C与相邻C形成的键角__________(填“>”、“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为____________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
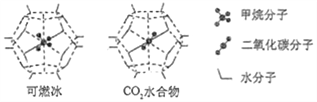
①“可燃冰”中分子间存在的2种作用力是___________________________;
②为开采深海海底的“可燃冰",有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想的依据是:___________________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
【答案】 3 sp3 < 氧化石墨烯可与水形成氢键更稳定 12 M3C60 ![]() ×100% (或34%) 氢键、范德华力 CO2的分子直径小于笼状结构空腔直径,且CO2与水的结合能大于CH4与水的结合能
×100% (或34%) 氢键、范德华力 CO2的分子直径小于笼状结构空腔直径,且CO2与水的结合能大于CH4与水的结合能
【解析】(1)由图可知,甲中,1号C与相邻C形成3个CC键,形成σ键的个数为3,故答案为:3;
(2)图乙中,1号C形成3个CC及1个CO键,C原子以sp3杂化,为四面体构型,而石墨烯中的C原子杂化方式均为sp2,为平面结构,则图乙中C与相邻C形成的键角<图甲中1号C与相邻C形成的键角,故答案为:sp3;<;
(3)水中的O电负性较强,吸引电子能力的强,易与氧化石墨烯中的OH上的H形成氢键,氧化石墨烯中O与水中的H形成氢键,因此在相同条件下所得到的分散系后者更为稳定。答案为:氧化石墨烯可与水形成氢键更稳定
(4)M原子位于晶胞的棱上与内部,棱上有12个M,内部有9个M,其个数为12![]() +9=12,C60分子位于顶点和面心,C60分子的个数为8×
+9=12,C60分子位于顶点和面心,C60分子的个数为8×![]() +6×
+6×![]() =4,M原子和C60分子的个数比为3:1,则该材料的化学式为M3C60,故答案为: 12 、 M3C60
=4,M原子和C60分子的个数比为3:1,则该材料的化学式为M3C60,故答案为: 12 、 M3C60
(5)若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则正方体对角线的![]() 就是C-C键的键长,即
就是C-C键的键长,即![]() a=2r,所以r=
a=2r,所以r=![]() a,碳原子在晶胞中的空间占有率
a,碳原子在晶胞中的空间占有率![]() 。答案为:
。答案为:![]() ×100%(或34%)
×100%(或34%)
(6) ① CH4与H2O形成的水合物俗称“可燃冰”,分子晶体中作用力是范德华力,水分子之间存在氢键②由表格可知:二氧化碳的分子直径小于笼状结构的空腔直径,即0.512<0.586,能顺利进入笼状空腔内,且二氧化碳与水的结合能力强于甲烷,即29.91>16.40,故答案为:①氢键、范德华力②CO2的分子直径小于笼状结构空腔直径,且CO2与水的结合能大于CH4与水的结合能


科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。只改变一个条件,则下列对图像的解读正确的是
①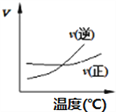 ②
②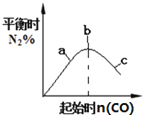 ③
③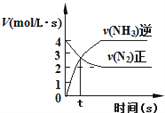 ④
④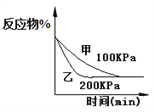
A. A2(g)+3B2(g)![]() 2AB3(g),如图①说明此反应的正反应是吸热反应
2AB3(g),如图①说明此反应的正反应是吸热反应
B. 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),如图②说明NO2的转化率b>a>c
N2(g)+4CO2(g),如图②说明NO2的转化率b>a>c
C. N2(g)+3H2(g)![]() 2NH3(g),如图③说明t秒时合成氨反应达到平衡
2NH3(g),如图③说明t秒时合成氨反应达到平衡
D. 2A(g)+2B(g)![]() 3C(g)+D(?),如图④说明生成物D一定是气体
3C(g)+D(?),如图④说明生成物D一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一定量的铁与足量的稀硫酸及足量的CuO反应制单质铜,有人设计了以下两种方案:①Fe![]() H2
H2![]() Cu ②CuO
Cu ②CuO![]() CuSO4
CuSO4![]() Cu,若按实验原理进行操作,则两者制得单质铜的量
Cu,若按实验原理进行操作,则两者制得单质铜的量
A. 一样多 B. ①多
C. ②多 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有质量分数为98%的浓硫酸,密度为1.84 g·cm-3。现要配制0.5mol/L的稀硫酸450 mL,试回答下列问题:
(1)该浓硫酸的物质的量浓度为_________。配制稀硫酸时,应选用规格为______mL的容量瓶,经计算需要__________mL浓硫酸。
(2)在量取浓硫酸后,进行了下列操作,其正确顺序是________________(填序号)。
a. 待稀释硫酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
b. 往容量瓶中小心加蒸馏水至液面离刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的凹液面与刻度标线相切。
c. 用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
d. 将浓硫酸慢慢注入盛蒸馏水的烧杯中,边倒边用玻璃棒搅动,使其混合均匀。
e. 将容量瓶盖紧,反复上下颠倒,摇匀。
(3)下列操作会导致所配硫酸浓度偏低的是______。
A.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
B.用量筒量取浓硫酸时,俯视读数
C.定容时仰视容量瓶刻度线
D.定容摇匀后有少量溶液外流
E. 定容摇匀后,发现液面下降,继续加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,p、q、m、n分别为常见的气体单质,p和s均为有色气体,q能在p中燃烧并产生苍白色火焰,v的水溶液呈碱性,t的水溶液呈酸性。回答下列问题:
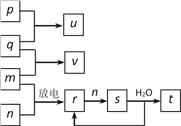
(1)新制p的水溶液中,除H2O、H+、OH-外,还含有____________等粒子(填化学式),该溶液中发生反应的离子方程式是___________。
(2)取2份新制p的水溶液,向第一份中滴入紫色石蕊溶液,现象是____________;第二份先滴入FeCl2溶液,后加入KSCN溶液,其现象是_____________,有关反应的离子方程式为_______________、_________________。
(3)反应“v+n→r”的化学方程式是__________,每转移2 mol电子,可生成标准状况下的r气体________L。s溶于水的反应中,氧化剂与还原剂的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 碳酸氢钠的水解:HCO3-+ H2O![]() H3O++ CO32-
H3O++ CO32-
B. 以硫酸铝和小苏打为主要反应物的泡沫灭火器中的反应原理:Al3+ +3HCO3-=Al(OH)3↓+3CO2↑
C. 1 mol/L NH4Al(SO4)2溶液中逐滴加入等体积4 mol/L NaOH溶液:Al3++4OH— = AlO2-+2H2O
D. 用惰性电极电解AlCl3溶液:2Cl- + 2H2O ![]() 2OH- + H2↑+ Cl2↑
2OH- + H2↑+ Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
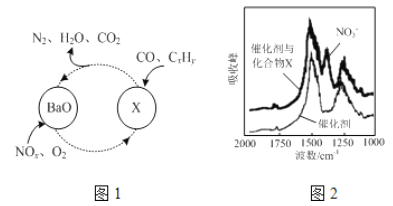
①在图示的转化中,被还原的元素是_______________,X的化学式为__________________。
②钡元素在周期表中的位置是___________________________。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的最之比为2:1时,写出发生反应的化学方程式:____________________________。
(3)利用ClO2氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2反应I的化学方程式是2NO+ ClO2+H2O==NO2+HNO3+ 2HCl,反应II的离子方程式是__________________。
N2反应I的化学方程式是2NO+ ClO2+H2O==NO2+HNO3+ 2HCl,反应II的离子方程式是__________________。
(4)加入过量次氯酸钠可使废水中NH4+完全转化为N2,而本身被还原为NaCl。
①检验废水中是否存在NH4+的方法是_______________________________________________。
②若处理废水产生了0.448LN2 (标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解精炼铜的说法中不正确的是
A. 电解质溶液中要含有Cu2+
B. 粗铜作阳极,精铜作阴极
C. 电解时,阳极发生氧化反应,阴极发生还原反应
D. 粗铜中所含Zn、Fe、Ni等杂质电解后以单质形式沉枳于阳极泥中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com