
 某实验小组用0.50mol/L NaOH 溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH 溶液和0.50mol/L硫酸溶液进行中和热的测定.分析 Ⅰ、根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;
Ⅱ.(1)中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
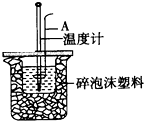
(2)仪器A的名称是环形玻璃搅拌棒;
(3)a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液和硫酸溶液的体积时都仰视读数(量筒),会导致所量NaOH溶液和硫酸溶液的体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多;
d.大烧杯上未盖硬纸板,热量散失较大
解答 解:Ⅰ、需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g;
故答案为:5.0;
Ⅱ.(1)稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,稀硫酸和稀氢氧化钠溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(2)仪器A的名称是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(3)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多,中和热的数值偏小,故c正确;
d.大烧杯上未盖硬纸板,热量散失较大,中和热的数值偏小,故d正确;
故答案为:b.
点评 本题考查热化学方程式的书写以及测定反应热的误差分析,难度中等,注意理解中和热的概念.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com