
| A. | 0.1mol/LHA溶液的pH=3.5 | |
| B. | 0.1mol/LHA溶液中,由HA电离出的c(H+)约为水电离出的c(H+)的106倍 | |
| C. | 0.1mol/LNaA溶液中,各离子浓度大小顺序为:c(Na+)>c(OH-)>c(A-)>c(H+) | |
| D. | 向0.1mol/LNaA溶液中加水稀释,所有离子浓度均降低 |
分析 室温时,0.1mol/l某一元酸HA的电离平衡常数K=$\frac{[{H}^{+}]•[{A}^{-}]}{[HA]}$=$\frac{[{H}^{+}]^{2}}{0.1}$=1×10-7,溶液中C(H+)=10-4mol/L,据此分析解答.
解答 解:室温时,0.1mol/l某一元酸HA的电离平衡常数K=$\frac{[{H}^{+}]•[{A}^{-}]}{[HA]}$=$\frac{[{H}^{+}]^{2}}{0.1}$=1×10-7,溶液中c(H+)=10-4mol/L,pH=4,故A错误;
B、该温度时,由HA电离出的C(H+)=10-4mol/L,水电离出的C(H+)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/l=10-10mol/L,所以由HA电离出的c(H+)约为水电离出的c(H+)的106倍,故B正确;
C、NaA溶液中水解是微弱的,所以离子浓度大小顺序应为c(Na+)>c(A-)>c(OH-)>c(H+),故C错误;
D、NaA溶液显碱性,加水稀释溶液碱性减弱,氢离子浓度增大,故D错误;
故选B.
点评 本题考查了弱电解质的电离,根据电离平衡常数公式、pH公式、弱电解质电离影响因素等知识点解答即可,注意B中水电离出氢离子浓度的计算方法,注意C中各微粒浓度的处理方法,这些都是易错点.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯水和二氧化硫都具有漂白作用,两者漂白原理相同 | |
| B. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 | |
| C. | 1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为1.5NA | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、Cl-、CO32- | B. | Fe3+、Mg2+、NO3-、SCN- | ||
| C. | NO3- H+、Fe2+、SO42- | D. | Na+、OH-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1molH2O所占体积约为22.4L | |
| B. | OH-所含电子数是10 | |
| C. | 0.5molH2和0.5molN2体积相同 | |
| D. | 从1L 0.5mol•L-1NaCl溶液中取出200mL溶液,其物质的量浓度为0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| C. | 用澄清石灰水溶液鉴别苏打、小苏打 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
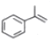 (异丙烯苯)$→_{一定条件}^{+H_{2}}$
(异丙烯苯)$→_{一定条件}^{+H_{2}}$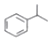 (异丙苯),下列说法错误的是( )
(异丙苯),下列说法错误的是( )| A. | 反应属于加成反应 | B. | 异丙苯的一氯代物共有6种 | ||
| C. | 可用溴水鉴别异丙烯苯和异丙苯 | D. | 异丙苯是苯的同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com