
����Ŀ����.��֪������������ճ������м�Ϊ�������ᣬ��һ�������£�CH3COOH ��Һ�д��ڵ���ƽ�⣺CH3COOH CH3COO-+H+ ��H>0��
��1�������£��� pH = 5 ��ϡ������Һ�У�c(CH3COO-)=_____�����ػ������з����У�����ʹ 0.10 mol��L-1 CH3COOH �ĵ���̶��������_____
a���������� 0.10 mol��L-1 ��ϡ���� b������ CH3COOH ��Һ
c����ˮϡ���� 0.010 mol��L-1 d����������������
e�����������Ȼ��ƹ��� f���������� 0.10 mol��L-1 �� NaOH ��Һ
��2������������пͶ�������� pH ������ 3 �Ĵ����������Һ�У�������ַ�Ӧ����ֻ��һ����Һ����п��ʣ�࣬�����������������V(����)_____V(����)����Ӧ���������Ϊ����(����)_____��(����)������д��>������<������=����
��3����֪��90��ʱ��ˮ�����ӻ�����Ϊ Kw=3.8��10-13���ڴ��¶��£��� pH=3 ������� pH=11 ������������Һ�������ϣ�������Һ�е� c(H+)=_____mol/L��������λ��Ч���֣���
��.��1�������£���֪ 0.1 mol��L-1 һԪ��HA ��Һ��c(OH-)/c(H+)=1��10-8�������£�0.1mol��L-1 HA��Һ�� pH=_____��
��2�������£��� pH=a �İ�ˮ�м�����������ʱ����Һ�����ԣ��������� pH_____(14-a)����д��>������<������=������
���𰸡�(10-5-10-9) mol/L bcf < = 2.05��10-11 3 <
��������
��.��1���� pH��5��ϡ������Һ�У�c��H+����10��5mol/L��������ˮ�������������Ũ����10��9mol/L�����Ը��ݴ���ĵ���ƽ�ⷽ��ʽCH3COOHH++CH3COO-���Կ�����c��CH3COO-����c��H+����(10��5��10��9)mol/L�����ȡ���ˮϡ�͡�����������ʾ���ʹ����ƽ�������ƶ������Դ�ѡbcf��
��2�����������ᣬ�������ͽ����ķ�Ӧ������ƽ�ⲻ�ϵ������ƶ�������������������ӣ����Դ����������������ϴ�V(����) <V(����)������ʼʱ������������pH������3������ʼʱ�����ӵ�Ũ����ȣ����Կ�ʼʱ�������������(����)=��(����)��
��3��pH��3��������c��H+����10��3mol/L��pH��11������������Һ��c��OH-���� =3.8��10��3mol/L����Ϻ�H����OH����H2O�����Լ�ʣ�࣬ʣ�����������Ũ��Ϊc��OH������
=3.8��10��3mol/L����Ϻ�H����OH����H2O�����Լ�ʣ�࣬ʣ�����������Ũ��Ϊc��OH������ ��0.0185mol/L������c��H+����
��0.0185mol/L������c��H+���� ��2.05��10-11��mol/L����
��2.05��10-11��mol/L����
��.��1��c(OH-)/c(H+)=1��10-8��c��OH������c��H����=1��10-14������c��OH����=10-11mol��L��1����c��H����=10-3mol��L��1��������Һ��pH=3��
��2�����谱ˮ��ǿ�����ʱ��pH=a�İ�ˮ������������Ũ��=10a-14mol��L��1����pH=a�İ�ˮ�м�����������ʱ����Һ�����ԣ�������������Ũ�ȵ���������Ũ�ȣ����������pH=14-a��ʵ���ϰ�ˮ��������������ͼ��Ϻ���Һ�����ԣ�˵�����Ũ�ȴ��ڼ��Ũ�ȣ��������pH��14-a��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�ش��������⡣
��1����֪Ksp(BaCO3) =2.6��l0-9��Ksp(BaSO4)=1.1��10-10��
��BaCO3��20 mL 0.01 mol��L��1Na2CO3��Һ�е�Ksp _________������ڡ�����С�ڡ����ڡ�������20 mL 0.01 mol��L��1 BaCl2��Һ�е�Ksp
���ֽ�Ũ��Ϊ2��10-4mol/LNa2CO3��Һ��BaCl2��Һ�������ϣ�������BaCO3��������BaCl2��Һ����СŨ��Ϊ_______mol/L��
������BaSO4�������Һ�еμ�Na2CO3��Һ������BaCO3��������ʱ����Һ��c(CO32��)/c(SO42��)=___________��������λ��Ч���֣���
��2����֪25�� ʱ��Ksp[AgCl]=1.8��10��10���ֽ������Ȼ����ֱ���룺a��100mL����ˮ�У�b��100mL 0.2 mol/LAgNO3��Һ�У�c��100mL 0.1 mol/L�Ȼ�����Һ�У�d��100mL 0.1 mol/L������Һ�С���ֽ�������ͬ�¶���������Ũ���ɴ�С��˳����_______________������д��ţ���b�������ӵ�Ũ��Ϊ__________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������;�������У�����ȷ����( )
A.Cl2����������ˮ����B.SO2������Ư��ʳƷ
C.SiO2������������άD.����ʳ�ο�Ԥ����״���״�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaN3)��������ȫ���ҵIJ�������Fe2O3������������NaHCO3����ȴ��������������������ײʱ���ֽ������������ʹ��ȫ����Ѹ�ٴ��Ӷ���ȫ�������ã���֪Ka(HN3)=1.8��10-5�ݡ������й�˵����ȷ����
A. NaHCO3����ȴԭ�����������ֽ⣬������ϵ������
B. Fe2O3��Na��Ӧ������������Na2O2
C. �����ʵ�����NaN3��HN3�����Һ�Լ���
D. ����6.5 gNaN3�ֽ����N2����ת��0.9 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ż��������һ��ҽҩ�м��壬����ͨ�����·�Ӧ�Ƶã�
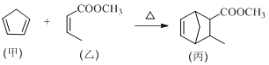
�����й�˵����ȷ����
A. ����������ԭ�ӿ��ܴ���ͬһƽ����
B. �ҿ���H2�����ʵ���֮��1��2�����ӳɷ�Ӧ
C. ����ʹ���Ը��������Һ�����CCl4��Һ��ɫ����ԭ����ͬ
D. �����ʵ����ļ����ҷֱ���ȫȼ��ʱ����������������֮��Ϊ13��12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ﳣ��Ũ������������̷�Ӧ����ȡ��������������Ӧ�Ļ�ѧ����ʽΪ MnO2 + 4HCl (Ũ)![]() MnCl2+ Cl2�� +2H2O �����Ƶñ�״����4.48L������
MnCl2+ Cl2�� +2H2O �����Ƶñ�״����4.48L������
��1���μӷ�Ӧ��HCl�������� __________ ��
��2����Ӧ��ʵ�ʱ�������HCl�����ʵ�����__________ mol
��3����Ӧ��ת�Ƶĵ��Ӹ���Ϊ ______________ .
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƾ���(CaO2��8H2O)������ҽҩ����������������̼���Ϊԭ�ϣ�������ʵ�鷽�����Ʊ���
![]()
�����й�˵����ȷ����
A. ����е���ҪĿ����Ϊ�˳�ȥ�ܽ��CO2
B. �ڵķ�Ӧ��H2O2������������ˮ����������Һ��pH
C. ���нᾧ�Ŀ�����С������ʱ���ò������������
D. �۴�ϴ����ҪĿ����Ϊ�˼��پ������ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.2 L��NaCl��Һ��MgCl2��Һ��CuCl2��Һ��ɵĻ����Һ�У��������ӵ�Ũ����ͼ��ʾ��
(1)���Һ�У�NaCl�����ʵ���Ϊ_______mol��MgCl2������Ϊ_______g��
(2)�û����Һ��CuCl2�����ʵ���Ũ��Ϊ_____molL��1�����û����Һ��ˮϡ�������Ϊ1 L��ϡ�ͺ���Һ��Cu2+�����ʵ���Ũ��Ϊ_______molL��1��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��.ij��Һ��Cl����CO![]() ��SO
��SO![]() ��Ҫ�����μ�������������ӣ����������ʵ����ƣ�
��Ҫ�����μ�������������ӣ����������ʵ����ƣ�
�������� | �����Լ� | ʵ������ | ���ӷ���ʽ |
��CO | ϡ���� | _________ | _________ |
��SO | _________ | ������ɫ���� | _________ |
�� Cl�� | _________ | ������ɫ���� | _________ |
��2��KCl��Ʒ�к�������K2CO3��K2SO4�Ͳ�����ˮ�����ʣ�Ϊ���ᴿKCl���Ƚ���Ʒ��������ˮ�У���ֽ������ˣ��ٽ���Һ����ͼ��ʾ������в�����
�ش��������⣺

���Լ����Ļ�ѧʽΪ________________���ж��Լ����Ѽӹ����ķ�����_____________��
�� ���м����Լ�����Ŀ����__________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com