
如右图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的 ZrO3固体,它在高温下能传导O2‑。下列说法正确的是
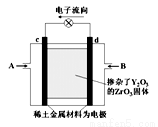
A.c电极名称为负极,气体A为空气
B.d电极上发生反应:CH4-8e-+4O2-=CO2+2H2O
C.O2‑向c电极移动
D.用此装置作电源电解精炼铜,d电极与粗铜相连
科目:高中化学 来源:2015-2016学年广西钦州港经济开发区中学高二上12月月考化学试卷(解析版) 题型:选择题
下列现象的产生与人为排放大气污染物氮 氧化物无关的是
氧化物无关的是
A.闪电 B.光化学烟雾 C.酸雨 D.臭氧空洞
查看答案和解析>>
科目:高中化学 来源:2016届福建省闽粤联合体高三上学期第三次联考化学试卷(解析版) 题型:选择题
下列分子或离子在指定的分散系中能大量共存的一组是
A.硝酸钠溶液:H+、Fe3+、SO42-、CH3COOH
B.烧碱溶液:K+、HSO3-、NO3-、NH3·H2O
C.空气:HCl、CO2、SO2、NO
D.氢氧化铁胶体:H+、K+、S2-、Br-
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上12月月考化学试卷(解析版) 题型:选择题
浙江大学成功研制出能在数分钟之内将电量充满的锂电池,其成本只有传统锂电池的一半。若电解液为LiAlCl4-SOCl2,电池的总反应为:4Li+2SOCl2 4LiCl+S+SO2。下列说法正确的是:
4LiCl+S+SO2。下列说法正确的是:
A.充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2
B.电池的电解液可用LiCl水溶液代替
C.放电时电子从负极经电解液流向正极
D.该电池放电时,负极发生还原反应
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上期末热身理综化学试卷(解析版) 题型:选择题
紫苏醇的结构简式如右图所示。下列有关紫苏醇的说法正确的是
A.与乙醇互为同系物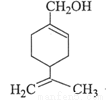
B.一定条件下能与乙酸发生酯化反应
C.存在属于芳香族化合物的同分异构体
D.能与溴水、酸性高锰酸钾溶液发生加成反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上第二次月考化学试卷(解析版) 题型:推断题
下图中A~J均为中学化学中常见的物质.它们之间有如下转化关系。其中,A、D为金属单质,A元素是地壳中含量最多的金属元素(反应过程中生成的水及其它产物己略去)
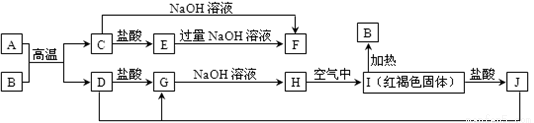
请回答以下问题:
(1)B是______,H是________(填化学式)。
(2)写出A直接转化为F的离子反应方程式:_____________。
(3)写出E与过量氨水反应的离子反应方程式:_______________。
(4)H在空气中转化为I 的化学反应方程式:__________________。
(5)写出A与B高温下发生的化学反应方程式__________________。
(6)用一个离子方程式表示E转化为F___________________。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期月考化学试卷(解析版) 题型:填空题
某学习小组依据反应:SO2(g)+ Cl2(g)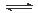 SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
SO2Cl2 | Cl2 | SO2 | |
熔点/℃ | –54.1 | –101 | –72.4 |
沸点/℃ | 69.1 | –34.6 | –10 |
性质 | 遇水发生剧烈水解 |
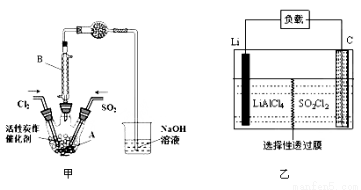
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,反应的离子方程式为______________;
(2)B仪器的作用是________________;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择_____。
A.冰水浴 B.常温 C.加热至69.1℃ D.沸水浴
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为____。
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应。充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式___________________。
(6) GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li+SO2Cl2 = 2LiCl+SO2,则电池工作时,正极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上第三次月考化学试卷(解析版) 题型:填空题
合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6 L NH3时,放出的热量为________。
2NH3(g) ΔH=-92.2 kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6 L NH3时,放出的热量为________。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示。由图可知:

①温度T1、T2时的平衡常数分别为K1、K2,则K1__________K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡__________移动(填“向左”、“向右”或“不”)。
②见右图,T2温度时,在1 L的密闭容器中加入2.1 mol N2、1.5 mol H2,经10 min达到平衡,则v(H2)=________mol/ (L.min)达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4 mol,则平衡________移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(l)+CO(NH2)2(l) ΔH,在一定压强下测得如下数据:
H2O(l)+CO(NH2)2(l) ΔH,在一定压强下测得如下数据:

①则该反应ΔH______0,表中数据a______d,b______f(均选填“>”、“=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?_________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上学期期中考试化学试卷(解析版) 题型:填空题
海带具有从海水中富集碘的能力,下面是从海带中提取碘单质的流程:

试回答:
(1)步骤a的操作名称是 ,步骤b中所加的物质是 。
(2)步骤c的操作名称是 ;该操作中涉及到的玻璃仪器有漏斗、烧杯和 。
(3)步骤d中发生反应的离子方程式为 。
(4)步骤e的操作名称是 ,操作时在含I2的溶液中加入CCl4,振荡、静置后,液体分为两层,下层液体呈 色。
(5)步骤f的操作名称是分液,所用的主要仪器是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com