
【题目】下列物质:①Ar ②Na2O2 ③AlCl3 ④HClO ⑤N2 ⑥MgF2 ⑦NH4Cl
(1)只存在共价键的是___,不存在化学键的是_____,离子化合物有_______
(2)由离子键和极性键构成的物质是__________
(3)N2的电子式为_____ HClO的电子式为________NH4Cl的电子式为___________
(4)用电子式表示MgF2的形成过程___________
【答案】③④⑤ ① ②⑥⑦ ⑦ ![]()
![]()
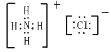
![]()
【解析】
①Ar中不含化学键;②Na2O2为离子化合物,由钠离子和过氧根离子构成,其含有离子键和非极性共价键;③AlCl3为共价化合物,其含有极性共价键;④HClO为共价化合物,其含有极性共价键;⑤N2中含有非极性共价键;⑥MgF2为离子化合物,由镁离子、氟离子构成,其含有离子键;⑦NH4Cl为离子化合物,由铵根离子和氯离子构成,其含有极性共价键和离子键。
(1)综上分析,③④⑤只存在共价键,①Ar不存在化学键,②⑥⑦为离子化合物。
(2) NH4Cl为离子化合物,由铵根离子和氯离子构成,铵根离子中含有极性共价键,铵根离子和氯离子间为离子键,则由离子键和极性键构成的物质是⑦NH4Cl。
(3)N2分子中氮原子之间为叁键,其电子式为![]() ;HClO中H原子与O原子共用一对电子,O原子与Cl原子共用一对电子,电子式为
;HClO中H原子与O原子共用一对电子,O原子与Cl原子共用一对电子,电子式为![]() ;NH4Cl由铵根离子和氯离子构成,其电子式为
;NH4Cl由铵根离子和氯离子构成,其电子式为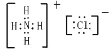 。
。
(4)氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为![]() 。
。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。回答下列问题:
某探究活动小组欲在实验室中模拟制取纯碱,设计了Ⅰ、Ⅱ两种方案,并选择其一进行实验。
方案Ⅰ:(1)将足量CO2通入饱和NaCl溶液中;(2)再在所得溶液中通入足量NH3;(3)过滤;
方案Ⅱ:(1)将足量NH3通入饱和NaCl溶液中;(2)再在所得溶液中通入足量CO2;(3)过滤;
(1)部分实验装置如图所示。制取氨气的装置应选用________(选填编号)。
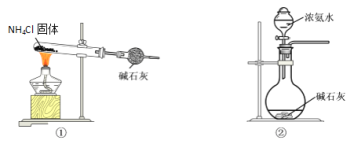
(2)写出实验中获得碳酸氢钠的离子方程式____________
(3)灼烧碳酸氢钠需要_________(选填编号)。
a.蒸发皿 b.坩埚 c.烧杯 d.烧瓶 e.酒精灯
(4)选择的实验方案是________(选填“Ⅰ”或“Ⅱ”),说明选择的理由_____________
(5)甲同学取少量产品完全溶于水,滴加稀硝酸2-3滴,再滴加硝酸银溶液,观察到有白色沉淀生成,得出纯碱含杂质Cl-的结论。乙同学认为甲的结论不一定正确,你认为乙同学的理由是____。
(6)按下列流程处理母液(提取完碳酸氢钠后的滤液)可得到NH4Cl。
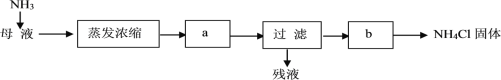
通入NH3的作用是_______(选填编号)。
a.增大NH4+浓度,使NaHCO3更多地析出
b.增大NH4+浓度,使NH4Cl更多地析出
c.使NaHCO3转化为溶解度更大的Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
Ⅰ.脱硝:
(1)H2还原法消除氮氧化物
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+133 kJ/mol
H2O(g)=H2O(l) ΔH2=-44 kJ/mol
H2的燃烧热ΔH3=-285.8 kJ/mol
在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为__________。
(2)用NH3催化还原法消除氮氧化物,发生反应:
4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) ΔH<0
5N2(g)+6H2O(l) ΔH<0
相同条件下,在2L恒容密闭容器中,选用不同催化剂,产生N2的量随时间变化如图所示。
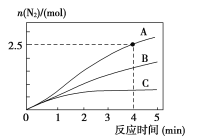
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=____。
②下列说法正确的是____。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已达到平衡
D.若反应在恒容绝热的密闭容器中进行,当K值不变时,说明已达到平衡
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH_____(填“增大”“减小”或“不变”),负极的电极反应式为________。
Ⅱ.脱碳:
(4)用甲醇与CO反应生成醋酸可消除CO污染。常温下,将a mol/L醋酸与b mol/L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),忽略溶液体积变化,计算醋酸的电离常数Ka=________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左 右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:

(1)写出甲同学实验中两个反应的化学方程式:_____________、___________________________。
(2)乙同学观察到的黑色物质是_____________,刺激性气体是_____________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

①设计装置a的作用是____________________
②浓溴水的作用是_______________________,稀溴水的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列气体:H2、Cl2、CH4、HCl、NH3、NO、H2S、SO2,用如图装置进行实验,填写下列空白:

(1)当烧瓶干燥时,从A口进气可收集的气体是___________,从B口进气可收集的气体是___________。
(2)当烧瓶中充满水时,可用来测___________等气体的体积。
(3)可用启普发生器制取的气体有___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,在4L密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:

(1)t1时刻N的转化率为____________。
(2)0~t3时间内用M表示的化学反应速率为____________mol/(L·min)。
(3)平衡时容器内气体的压强与起始时容器内压强的比值为____________。
(4)该反应的化学方程式为______;t2时刻,正逆反应速率大小:v正 ____v逆(填“>”、“=”或“<”)。
(5)下列能表示上述反应达到化学平衡状态的是____________(填编号)
A.v逆(M)=2v正(N) B.M与N的物质的量之比保持不变
C.混合气体密度保持不变 D.容器中压强保持不变
(6)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法不正确的是( )
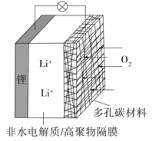
A.放电时,多孔碳材料电极为正极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li+向锂电极迁移
D.充电时,电池总反应为Li2O2-x=2Li+ (1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组分子中,都由极性键构成的极性分子的一组是
A. C3H6和CO2 B. CCl4和H2S C. H2O和NH3 D. H2O2和CS2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com