
| A. | 聚乙烯可发生加成反应 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 淀粉、纤维素完全水解后的产物相同 | |
| D. | 油脂属于高分子化合物 |
分析 A、聚乙烯为乙烯加聚反应的产物,不含有碳碳双键;
B、石油的分馏是利用有机物沸点不同分离有机物的过程,属于物理变化;
C、淀粉与纤维素的水解产物均是葡萄糖;
D、相对分子质量大于10000的属于高分子化合物.
解答 解:A、聚乙烯为断开乙烯中双键,加聚后生成的产物,分子中不含有碳碳双键,不能再发生加成反应,故A错误;
B、石油分馏可得汽油和煤油属于物理变化过程,干馏是指隔绝空气加强热,属于化学变化,故B错误;
C、淀粉与纤维素的最终水解产物均是葡萄糖,故C正确;
D、油脂属于小分子化合物,故D错误,
故选C.
点评 本题主要考查的是高分子化合物概念、石油的分馏、聚乙烯的结构等,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 火炬燃烧时化学能只转化为热能 | |
| B. | 所有的燃烧反应都会放出热量 | |
| C. | 1molC3H8和5molO2的总能量大于3molCO2和4molH2O的总能量 | |
| D. | 丙烷为环保型燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中的压强不再发生变化 | |
| B. | X、Y、Z的物质的量之比为1:2:2 | |
| C. | X、Y、Z的速率之比1:2:2 | |
| D. | 单位时间内生成n mol Z,同时消耗n mol Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、SO2、BF2、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构 | |
| B. | CCl4和NH3都是以极性键结合的极性分子,P4和NO2都是共价化合物 | |
| C. | 在CaO和SiO2晶体中,都不存在单个小分子 | |
| D. | π键是由两个p电子“头碰头”重叠形成,σ键是镜面对称,而π键是轴对称 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
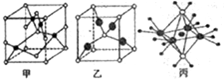
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向鸡蛋白溶液中加浓(NH4)2SO4溶液,有沉淀析出,再加足量的水,沉淀不溶解 | |
| B. | 将SO2通入酸性KMnO4溶液中,溶液褪色,证明SO2具有漂白性 | |
| C. | 取样灼烧,可以鉴别某白色纺织品是棉纺织品还是羊毛制品 | |
| D. | 向新制的Na2S溶液中滴加氨水产生淡黄色沉淀,可证明非金属性S>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| B. | 将标准状况下1.12L氯气通入10mL 1mol•L-1的溴化亚铁溶液中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | |
| C. | 氢氧化铁溶于氢碘酸溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积混合:AlO2-+4H+=Al3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,CH3COONa和CH3COOH混合溶液中[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| B. | 在O.1mol•L-1Na2C03溶液中:cc(Na+)=2c(CO32-) | |
| C. | 在O.1mol•L-1NaHC03溶液中:c(HCO3-)>c(CO32-)>c(H2C03) | |
| D. | 向0.2mol•L-1NaHC03溶液中加入等体积O.1mol•L-1NaOH溶液:c(CO32-)+c(HCO3-)+c(OH-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
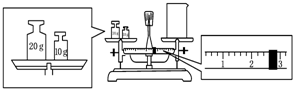 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液250mL:
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液250mL:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com