
【题目】(1)Ba(OH)2·8H2O固体与NH4Cl固体反应的化学方程式为_____________。
(2)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。理论上,每生成1 mol NH3___________热量(填“吸收”或“放出”)__________kJ;事实上,反应的热量总小于理论值,为什么?________________。
(3)一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)
5N2(g) + 6H2O(g),某次实验中测得容器内NO及N2的物质的量随时间变化如下图甲所示,图中b点对应的速率关系是v(正) _____ v(逆) ; d点对应的速率关系是v(正) ___________ v(逆)。(填“﹥”、“﹤”或“﹦”)

(4)已知N2(g)+ 3H2(g) ![]() 2NH3(g),若反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______;若平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______。
2NH3(g),若反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3达到平衡时浓度的范围为_______;若平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,则NH3起始时浓度的范围为______。
(5)已知一定条件下发生:2SO2(g) + O2(g) ![]() 2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)
2SO3(g) (正反应放热),在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件)

t1________________________;t2________________________;
t3________________________;t4________________________。
(6)①某电池采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液,电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S,此电池中_______作正极,负极的电极反应为_________________。
②甲烷燃料电池示意图如上图乙,其负极反应方程式为_____________。
【答案】Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑ 放出 46 该反应是可逆反应,充分反应的最终结果是达到最大限度(即化学平衡状态),因此放出的热量总是小于理论计算值 > = 0<c(NH3) <0.3 mol/L 0≤c(NH3) ≤0.3 mol/L t1:加压或增大反应物浓度(充入SO2或O2) t2:加入催化剂 t3:减压或减小反应物浓度 (分离移除SO2或O2) t4:减小生成物浓度(分离移除SO3) 石墨 Li— eˉ=Li + CH4 + 10OHˉ— 8eˉ= CO32ˉ + 7H2O
【解析】
(1)Ba(OH)2·8H2O固体与NH4Cl固体不断搅拌反应生成氯化钡、氨气和水;
(2)合成氨反应中,断裂化学键吸收能量,形成化学键放出能量,由吸收能量和放出能量的大小判断反应放出热量还是吸收热量;合成氨反应为可逆反应,反应不能完全反应;
(3)由图可知,a点和b点时,反应未达到平衡, c点和d点时,反应达到平衡;
(4)由可逆反应可以从正反应方向开始达到平衡,也可以从逆反应方向开始达到平衡确定NH3起始和平衡时浓度的范围,确定平衡时浓度的范围时注意可逆反应反应不能完全反应;
(5)该反应是一个气体体积减小的放热反应,依据题给图示确定正反应速率的变化和移动方向,判断条件的变化;
(6)①由电池总反应方程式可知,锂元素化合价升高,硫元素化合价降低,则锂电极为原电池负极,石墨电极为正极;
②由甲烷燃料电池示意图可知,通入氧气的一极为正极,通入甲烷的一极为负极。
(1)Ba(OH)2·8H2O固体与NH4Cl固体不断搅拌反应生成氯化钡、氨气和水,反应的化学方程式为Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑,故答案为:Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑;
(2)在反应N2+3H2![]() 2NH3中,断裂3molH-H键和1molN三N键共吸收的能量为3×436kJ+943kJ=2251kJ,生成2molNH3,共形成6molN-H键,放出的能量为6×391kJ=2346kJ,吸收的能量少,放出的能量多,则该反应为放热反应,放出的热量为2346kJ-2251kJ=95kJ,则生成1molNH3放出热量为46kJ;由于合成氨反应为可逆反应,反应不能完全反应,所以反应的热量总小于理论值,故答案为:放出;46;该反应是可逆反应,充分反应的最终结果是达到最大限度(即化学平衡状态),因此放出的热量总是小于理论计算值;
2NH3中,断裂3molH-H键和1molN三N键共吸收的能量为3×436kJ+943kJ=2251kJ,生成2molNH3,共形成6molN-H键,放出的能量为6×391kJ=2346kJ,吸收的能量少,放出的能量多,则该反应为放热反应,放出的热量为2346kJ-2251kJ=95kJ,则生成1molNH3放出热量为46kJ;由于合成氨反应为可逆反应,反应不能完全反应,所以反应的热量总小于理论值,故答案为:放出;46;该反应是可逆反应,充分反应的最终结果是达到最大限度(即化学平衡状态),因此放出的热量总是小于理论计算值;
(3)由图可知,a点和b点时,反应未达到平衡,为平衡的形成过程,对应的速率关系是v(正)>v(逆),c点和d点时,反应达到平衡,对应的速率关系是v(正)=v(逆),故答案为:>;=;
(4)反应起始时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,若反应正向进行,反应最大限度时,N2、H2 、NH3的浓度分别为(0.1—0.1)mol/L =0mol/L、(0.3—0.3)mol/L =0mol/L、(0.1+0.2)mol/L =0.3 mol/L,若反应逆向进行,反应最大限度时,N2、H2 、NH3的浓度分别为(0.1+0.05)mol/L =0.15mol/L、(0.3+0.15)mol/L =0.45mol/L、(0.1—0.1)mol/L =0 mol/L,由于该反应为可逆反应,则NH3达到平衡时浓度的范围为0<c(NH3) <0.3 mol/L;平衡时N2、H2 、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L,若反应正向进行,起始时,N2、H2 、NH3的浓度分别为(0.1+0.05)mol/L =0.15mol/L、(0.3+0.15)mol/L =0.45mol/L、(0.1—0.1)mol/L =0 mol/L,若反应逆向进行,起始时,N2、H2 、NH3的浓度分别为(0.1—0.1)mol/L =0mol/L、(0.3—0.3)mol/L =0mol/L、(0.1+0.2)mol/L =0.3 mol/L,则NH3起始时浓度的范围为0≤c(NH3) ≤0.3 mol/L,故答案为:0<c(NH3) <0.3 mol/L;0≤c(NH3) ≤0.3 mol/L;
(5)该反应是一个气体体积减小的放热反应,由图可知,t1时,正反应速率增大,平衡向正反应方向移动,则改变条件可能为增大压强或增大反应物浓度;t2时,正反应速率增大,平衡不移动,则改变条件可能为使用了合适的催化剂; t3时,正反应速率减小,平衡向逆反应方向移动,则改变条件可能为减压或减小反应物浓度 (分离移除SO2或O2);t4时,正反应速率不变,平衡向正反应方向移动,则改变条件可能为减小生成物浓度,故答案为:加压或增大反应物浓度(充入SO2或O2)加入催化剂;减压或减小反应物浓度span> (分离移除SO2或O2);减小生成物浓度(分离移除SO3);
(6)①由电池总反应方程式可知,锂元素化合价升高,硫元素化合价降低,则锂电极为原电池负极,失去电子发生氧化反应生成锂离子,电极反应式为Li— eˉ=Li +,石墨电极为正极,SOCl2在正极得到电子发生还原反应,故答案为:石墨;Li— eˉ=Li +;
②由甲烷燃料电池示意图可知,通入氧气的一极为正极,氧气在正极得到电子发生还原反应,通入甲烷的一极为负极,碱性条件下,甲烷在负极失去电子发生氧化反应生成碳酸根,电极反应式为CH4 + 10OHˉ— 8eˉ= CO32ˉ + 7H2O,故答案为:CH4 + 10OHˉ— 8eˉ= CO32ˉ + 7H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,c(H+)/c(ClO-)减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用序号填写下列空格:
①O2和O3②H2、D2和T2③12C和14C④石墨和足球烯(C60)⑤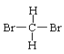 和
和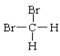 ⑥正丁烷和异丁烷⑦
⑥正丁烷和异丁烷⑦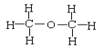 和
和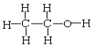 ⑧CH3CH3和CH3CH2CH2CH3
⑧CH3CH3和CH3CH2CH2CH3
互为同素异形体的是___;互为同位素的是__,互为同分异构体的是__,互为同系物的是__,同一种物质的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 植物油的主要成分是高级脂肪酸
B. 异丙苯(![]() )中碳原子可能处于同一平面上
)中碳原子可能处于同一平面上
C. 某些蛋白质可溶于溶剂形成分子胶体,但遇乙醇发生变性
D. 分子式为C4H10O并能与金属钠反应的有机物有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3kJ/mol
B. KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol
K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol
C. C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(g) ΔH=-5518kJ/mol
O2(g)=8CO2(g)+9H2O(g) ΔH=-5518kJ/mol
D. 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1) ΔH=-5518kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有H2O2溶液的试管中滴入少量浓盐酸,经检验生成的混合气体中只含有O2、Cl2、HCl和水蒸气。将气体通入X溶液(如图),依据观察到的现象,能判断气体中含有Cl2的是
选项 | X溶液 | 现象 |
|
A | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 | |
B | 滴有KSCN的FeSO4溶液 | 溶液变为血红色 | |
C | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
D | 紫色石蕊溶液 | 溶液先变红后褪色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出一氯甲烷的电子式____,乙烯的结构式____;
(2)乙醇催化氧化的方程式:____;
(3)写出苯和液溴在催化剂作用下生成溴苯的化学方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com