
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处
理,使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②____Na2FeO2+____NaNO2+____H2O―→____Na2Fe2O4+____NH3↑____+NaOH
③Na2FeO2+Na2Fe2O4+2H2OFe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为________,被还原的是______________________。若有1 mol Na2FeO2生成,则反应中有____ mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是________。
A.该生产过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:________________________________________________________________________。
答案 (1)6 1 5 3 1 7
(2)Fe 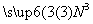 (或+3价的N) 2
(或+3价的N) 2
(3)BD
(4)反应③为可逆反应,氢氧化钠浓度过大,平衡向逆反应方向移动
解析 (1)根据氧化还原反应中得失电子守恒配平方程式,其计量数分别是6,1,5,3,1,7;(2)该反应中还原剂是铁,被还原的是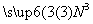 (或+3价的N),若有1 mol Na2FeO2生成,则反应中有(2-0) mol=2 mol电子转移;(3
(或+3价的N),若有1 mol Na2FeO2生成,则反应中有(2-0) mol=2 mol电子转移;(3 )A项,该反应中有氨气生成,所以产生污染,错误;B项,四氧化三铁是致密的保护层,所以具有抗腐蚀性,正确;C项,③不是氧化还原反应,错误;D项,反应①②中的氧化剂均为NaNO2,故正确;(4)反应③可逆,氢氧化钠浓度过大,平衡向逆反应方向移动。
)A项,该反应中有氨气生成,所以产生污染,错误;B项,四氧化三铁是致密的保护层,所以具有抗腐蚀性,正确;C项,③不是氧化还原反应,错误;D项,反应①②中的氧化剂均为NaNO2,故正确;(4)反应③可逆,氢氧化钠浓度过大,平衡向逆反应方向移动。


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:
某无色混合气体可能由NH3、NO、CO2、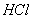 、O2中的二种或几种组成。室温下50mL的混合气体通过足量的浓硫酸,体积减少至40mL,再通过足量的NaOH溶液,体积减少到20 mL,余下的气体接触空气后立即变色。试推断:
、O2中的二种或几种组成。室温下50mL的混合气体通过足量的浓硫酸,体积减少至40mL,再通过足量的NaOH溶液,体积减少到20 mL,余下的气体接触空气后立即变色。试推断:
(1)余气接触空气变色的化学方程式为 ;
(2)原混合气体中一定含有 气体;
(3)混合气体在同温、同压下的体积比为 (按气体顺序)
(4)原混合气体中一定不含 气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)____ClO-+____Fe(OH)3+____===____Cl-+____FeO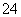 +____H2O
+____H2O
(2)____MnO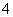 +____H2O2+____===____Mn2++____O2↑+____H2O
+____H2O2+____===____Mn2++____O2↑+____H2O
(3)某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有:Al2O3、C、N2、AlN、CO。
请将AlN之外的反应物与生成物分别填入以下空格内,并配平。
 +
+ +
+ ―→
―→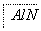 +
+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应SiO2+3C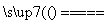 SiC+2CO↑的叙述中,正确的是 ( )
SiC+2CO↑的叙述中,正确的是 ( )
A.氧化剂是SiO2
B.氧化剂与还原剂的物质的量之比为1∶2
C.碳在反应中只作还原剂
D.若生成1 mol SiC,则转移电子2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100 mol·L-1 Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O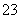 将转化为 ( )
将转化为 ( )
A.S2- B.S C.SO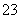 D.SO
D.SO
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定中和反应的反应热,计算时至少需要的数据是
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量 ⑤生成水的物质的量 ⑥反应前后溶液温度变化 ⑦操作所需的时间
A.①②③⑥ B.①③④⑥
C.③④⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
21世纪是钛的世纪。在800℃~1 000℃时电解TiO2可制得钛,装置如右图所示。下列叙述正确的是
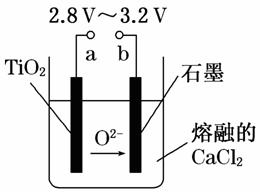
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为:TiO2+4e-===Ti+2O2-
D.每生成0.1 mol钛,转移电子0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图:
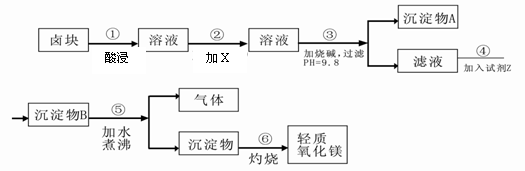
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH 表2 化学试剂价格表
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2 ,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
根据有机化合物的命名原则,下列命名正确的是( )
A.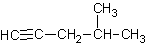 4-甲基-1,2-戊炔
4-甲基-1,2-戊炔
B.CH3 CH (CH3)CH=CHCH3 2-甲基-3-戊烯
C.  2, 2, 3-甲基戊烷
2, 2, 3-甲基戊烷
D.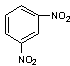 间二硝基苯
间二硝基苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com