
| A. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯 | |
| B. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 | |
| C. | 常见的合成纤维有涤纶、尼龙等,涤纶纤维是以苯二甲酸、乙二酸为主要原料合成的 | |
| D. | 硫、白磷、臭氧、碳-60、氩、水等物质固态时都是分子晶体,分子内都存在共价键 |
科目:高中化学 来源: 题型:解答题
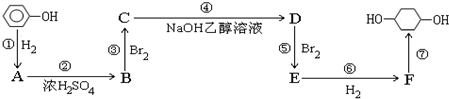
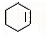 ; F
; F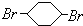 ;
;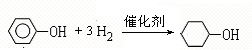 ;
;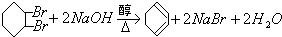 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
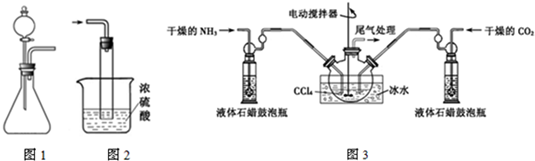
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 原子的M电子层上有3个电子 |
| C | 在短周期元素中,其原子半径最大 |
| D | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成D的单质和H2O |
| E | 元素最高价正价与最低负价的代数和为6 |
| A. | A的气态氢化物具有还原性,常温下,该氢化物水溶液的PH>7 | |
| B. | C单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2 | |
| C. | 有B和E所形成的化合物中存在离子键,属于离子晶体 | |
| D. | C与D可形成不同原子个数比的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
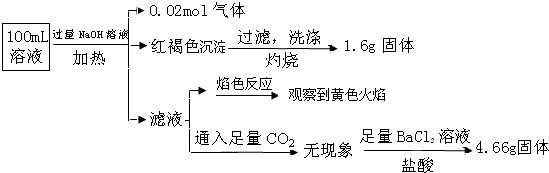
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖及其水解产物均能发生银镜反应 | |
| B. | 用酸性KMnO4溶液即可鉴别2-丁烯和正丁醛 | |
| C. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| D. | 用甘氨酸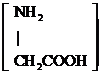 和丙氨酸 和丙氨酸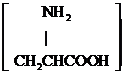 缩合最多可形成3种二肽 缩合最多可形成3种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 |
| 分子式 | C2H6O2 | C3H8O3 |
| 熔点/℃ | -11.5 | 17.9 |
| 沸点/℃ | 198 | 290 |
| 密度/g•cm-3 | 1.11 | 1.26 |
| 溶解性 | 易溶于水和酒精 | 易溶于水和酒精 |
| A. | 萃取法 | B. | 升华法 | C. | 蒸馏法 | D. | 分液法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com