
研究NO2、SO2、等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为 3NO2+H2O=NO+2HNO3 .利用反应6NO2+8NH3 7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 6.72 L.
7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 6.72 L.
(2)已知:2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ•mol﹣1
2NO(g)+O2(g)⇌2NO2(g)△H=﹣113.0kJ•mol﹣1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的△H= ﹣41.8 kJ•mol﹣1.
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 b .
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= .
| 用盖斯定律进行有关反应热的计算;化学平衡状态的判断.. | |
| 专题: | 化学反应中的能量变化;化学平衡专题. |
| 分析: | (1)二氧化氮可以和水反应生成硝酸和一氧化氮,根据化学方程式以及电子转移知识来回答; (2)根据盖斯定律来计算化学反应的焓变,根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;根据三行式以及化学平衡常数表达式计算化学平衡常数. |
| 解答: | 解:(1)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO;6NO2+8NH3═7N2+12H2O,当反应中有1 mol NO2参加反应时,共转移了4 mol电子,故转移1.2mol电子时,消耗的NO2为1.2××22.4L=6.72L,故答案为:3NO2+H2O=NO+2HNO3;6.72; (2)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=﹣83.6 kJ•mol﹣1,则NO2+SO2⇌SO3+NO,△H=﹣41.8 kJ•mol﹣1; 本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据,故选b; NO2(g)+SO2(g) 起始物质的体积 1a 2a 0 0 转化物质的体积 x x x x 平衡物质的体积 1a﹣x 2a﹣x x x 则(1a﹣x):(2a﹣x)=1:6,故x=a,故平衡常数为=x2/(1a﹣x)(2a﹣x)=. 故答案为:﹣41.8;b;. |
| 点评: | 本题将元素化合物与能量变化、化学平衡等知识柔和在一起进行考察,充分体现了高考的综合性,看似综合性较强的问题,只要细细分析,还是能各个突破的. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.04mol气体;
第三份加足量BaCl2溶液后,得到干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g
综合上述实验,你认为以下结论正确的是 ( )
A.该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-
B.该混合液中—定含有:NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+
D.该混合液中:c(K+) ≥ 0.02mol/L c(CO32-) = 0.02mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,在一定条件下,进行下列反应:NO(g) + CO(g)  1/2N2(g) + CO2(g);△H <0(正反应放热),达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
1/2N2(g) + CO2(g);△H <0(正反应放热),达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2═2N0,经测定前3s用N2表示的反应速率为0.1mol/(L•s),则6S末N0的浓度为( )
|
| A. | 1.2 mol•L﹣1 | B. | 大于1.2 mol•L﹣1 | C. | 小于1.2 mol•L﹣1 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一个2L的密闭容器中加入4mol A和2mol B进行如下反应:3A(g)+2B(g)⇌4C(s)+D(g),反应2min后达到平衡,测得生成1.6mol C,下列说法正确的是( )
|
| A. | 前2 min D的平均反应速率为0.2 mol•L﹣1•min﹣1 |
|
| B. | 此时,B的平衡转化率是40% |
|
| C. | 增大该体系的压强,平衡不移动 |
|
| D. | 增加B,平衡向右移动,B的平衡转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
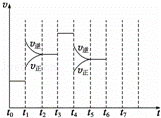
在一密闭容器中发生反应N2+3H2⇌2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
回答下列问题:
(1)处于平衡状态的时间段是 ACDF (填选项).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 A (填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线.
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 5:6 .
查看答案和解析>>
科目:高中化学 来源: 题型:
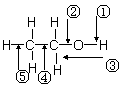
乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明正确的是
A.和金属钠作用时,键②断裂
B.和浓硫酸共热至170 ℃时,键①和⑤断裂
C.和乙酸、浓硫酸共热时,键①断裂
D.在铜催化下和氧气反应时,键①和②断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.固体NaCl不导电,但NaCl是电解质
B.Cu能导电,所以Cu是电解质
C.NH3溶于水能导电,所以NH3是电解质
D.BaSO4的水溶液不导电,所以BaSO4是非电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com