
分析 (1)高温下,铝粉能与Fe3O4发生铝热反应生成Al2O3与Fe;
Fe3O4相当于FeO.Fe2O3,被还原的HNO3转化为NO,根据电子转移守恒计算;
(2)血液属于胶体,遇电解质可以发生凝聚;胶体具有丁达尔效应,而溶液没有;
(3)Na2FeO4中铁为+6价,具有很强的氧化性;
该电池充电时阳极发生氧化反应,Fe(OH)3发生氧化反应生成FeO42-,根据电荷守恒可知OH-参与反应,再结合电荷守恒与原子守恒配平;
(4)参加反应的铁粉为与铁离子反应及与氢离子反应的两部分之和,根据氢气的体积计算出与盐酸反应的铁的物质的量及HCl的物质的量,再根据氯原子守恒,求出氯化铁的物质的量,进而求出与铁离子反应的铁的物质的量.
解答 解:(1)高温下,铝粉能与Fe3O4发生铝热反应生成Al2O3与Fe,反应方程式为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,
34.8g Fe3O4的物质的量为$\frac{34.8g}{232g/mol}$=0.15mol,Fe3O4相当于FeO.Fe2O3,被还原的HNO3转化为NO,根据电子转移守恒,被还原的HNO3的物质的量为$\frac{0.15mol×(3-2)}{5-2}$=0.05mol,
故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;0.05;
(2)FeCl3是电解质,可使血红蛋白迅速凝聚,从而达到止血作用;
Fe(OH)3胶体具有丁达尔效应,FeCl3溶液没有,鉴别二者的方法为:用激光笔照射,有丁达尔现象的是Fe(OH)3胶体,无丁达尔现象的是FeCl3溶液,
故答案为:FeCl3是电解质,可使血红蛋白迅速凝聚,从而达到止血作用;用激光笔照射,有丁达尔现象的是Fe(OH)3胶体,无丁达尔现象的是FeCl3溶液;
(3)Na2FeO4中铁为+6价,具有很强的氧化性,能杀灭水中的细菌和病毒,
该电池充电时阳极发生氧化反应,Fe(OH)3发生氧化反应生成FeO42-,根据电荷守恒可知OH-参与反应,结合电荷守恒与原子守恒,阳极反应方程式为:Fe(OH)3+5OH--3e-=FeO42-+4H2O,
故答案为:Na2FeO4中铁为+6价,具有很强的氧化性,能杀灭水中的细菌和病毒;Fe(OH)3+5OH--3e-=FeO42-+4H2O;
(4)氢气的物质的量为 $\frac{2.24L}{22.4L/mol}$=0.1mol,
Fe~~~~2HCl~~~H2
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为$\frac{1}{3}$×(0.13L×5mol/L-0.2mol)=0.15mol,
Fe~~~2FeCl3
0.075mol 0.15mol
所以参加反应的铁粉的质量为(0.1mol+0.075mol)×56g/mol=9.8g,
故答案为:9.8g.
点评 本题考查氧化还原反应计算、混合反应有关计算、电极反应式书写、胶体性质等,属于拼合型题目,侧重考查学生分析计算能力以及对知识的迁移运用,难度中等.


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 放热反应中反应物的总焓大于生成物的总焓 | |
| B. | 原子组成分子一定放出热量 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 化石燃料在地球上的蕴藏量是有限的,而且又都是经过亿万年才能形成的非再生资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
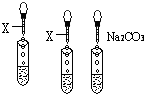 实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种常见酸碱指示剂X 或Na2CO3一次鉴别它们.根据有关操作及所加试剂填空.
实验室有三瓶失去标签的无色溶液:氯化钾、氢氧化钙和稀硫酸,可用一种常见酸碱指示剂X 或Na2CO3一次鉴别它们.根据有关操作及所加试剂填空.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+2 H+=Fe3++H2↑ | B. | Fe3++Cu=Cu2++Fe2+ | ||
| C. | Cu+2H+=Cu2++H2↑ | D. | 2Fe3++Fe=3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{13}$O和14O互称同素异形体 | B. | 丙烷和异丁烷互称同系物 | ||
| C. | 金刚石和石墨互称同位素 | D. | 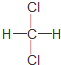 和 和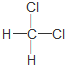 互称同分异构体 互称同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com