
【题目】现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式: C 、H
(2)写出反应③的化学方程式: 写出反应⑦的离子方程式:
(3)实验室检验物质G中阳离子的常用试剂是: 实验室检验物质D中阳离子的方法是
(4)写出物质D溶液加入物质F溶液中反应的离子方程式 ;该物质露置空气中发生反应的化学方程式 。
【答案】(1)FeFe(OH)3
(2)反应③:2Al+2NaOH+2H2O==2NaAlO2+3H2↑(2分)
反应⑦:2Fe3++Cu==2Fe2++Cu2+(2分)
(3)KSCN或NaOH溶液(其他合理答案亦可)(2分),焰色反应(2分)
(4)Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3(各2分)
【解析】
试题分析:金属A的焰色反应是黄色,说明A是钠,钠和水反应生成氢气和氢氧化钠,则D是氢氧化钠,甲是氢气,黄绿色气体应该是氯气,即乙是氯气,所以丙是氯化氢,E是盐酸,能和氢氧化钠反应生成氢气的金属应该是铝,即B是铝,红褐色沉淀H应该是氢氧化铁,所以G是氯化铁,则F是氯化亚铁,所以金属C是铁,紫红色金属I是铜。
(1)根据上述分析,C、H分别为铁和氢氧化铁,化学式为Fe、Fe(OH)3 .
(2)反应③是铝与NaOH溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2NaOH+2H2O == 2NaAlO2+ 3H2↑;反应⑦是铜与氯化铁反应生成氯化亚铁和氯化铜,离子方程式为2Fe3++Cu==2Fe2++Cu2+。
(3)根据上述分析,物质G为氯化铁,检验Fe3+的常用试剂是KSCN或NaOH溶液;物质D为氢氧化钠,检验Na+常用的方法是焰色反应。
(4)根据上述分析,物质D为NaOH,F为氯化亚铁,两者反应生成氯化亚铁白色沉淀,离子方程式为Fe2+ + 2OH- =Fe(OH)2↓;氢氧化亚铁不稳定,露置在空气中会被氧气氧化成红褐色的氢氧化铁,化学反应方程式为4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
实验:向2 mL FeCl2溶液中滴加2滴0.1 molL-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 molL-1、pH约为5(酸性环境)),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示实验中溶液变红的原因: 、 。
(2)甲探究实验中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 molL-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,变红,通入O2,无明显变化。
① 实验I说明 ;②实验III说明 。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种物质,只有在加热的条件下才能反应并产生气体的是( )
A.Cu+H2SO4(稀)
B.Cu+HNO3(浓)
C.Fe+HNO3(稀)
D.C+H2SO4(浓)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象的描述正确的是
A. 氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾
B. 铁丝在氯气中燃烧,产生棕褐色的浓烟,产物溶于水,溶液呈浅绿色
C. 铜在氯气中燃烧,产生棕黄色烟,产物溶于水,溶液呈蓝绿色
D. 钠在空气中燃烧,发出黄色的火焰,生成白色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是

A. 元素W的最高价氧化物对应水化物的酸性比Q的强
B. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氧化镁、氧化铝的混合物完全溶于200 mL盐酸,而后逐滴加入1.0 mol·L-1的NaOH溶液。溶液中生成沉淀的物质的量随加入的NaOH的溶液体积的变化,如图所示。
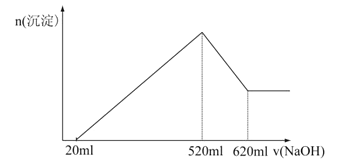
(1)试说明最初加入的20 mL NaOH溶液的作用。
(2)求所用盐酸的物质的量浓度。
(3)求氧化镁、氧化铝物质的量之比。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com