
| A. | 热稳定性:NaHCO3<Na2CO3 | |
| B. | 不可用氢氧化钙鉴别两者 | |
| C. | 两溶液碱性相同时的浓度:Na2CO3>NaHCO3 | |
| D. | 与同浓度的硫酸溶液反应放出气泡的快慢程度:NaHCO3>Na2CO3 |
分析 A、NaHCO3与Na2CO3相比较,NaHCO3不稳定,加热易分解;
B、Na2CO3与NaHCO3和氢氧化钙反应产生白色的沉淀碳酸钙;
C、碳酸根离子的水解程度大于碳酸氢根离子的水解程度;
D、与酸反应时,NaHCO3反应剧烈,碳酸钠和少量的酸反应得到碳酸氢钠.
解答 解:A.NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,碳酸钠受热稳定,所以热稳定性:NaHCO3<Na2CO3,故A正确;
B、Na2CO3与NaHCO3和氢氧化钙反应都会产生白色的沉淀碳酸钙,无法用氢氧化钙鉴别两者,故B正确;
C、碳酸根离子的水解程度大于碳酸,氢钠的水解程度两溶液碱性相同时的浓度:Na2CO3<NaHCO3,故C错误;
D、分别滴加硫酸溶液,碳酸钠反应离子方程式为CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故D正确;
故选C.
点评 本题考查Na2CO3和NaHCO3性质,题目难度不大,注意把握Na2CO3和NaHCO3性质的异同,注重基础知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向氨水中加入氢氧化钠或氯化铵都能使氨水的电离平衡逆向移动,一水合氨的电离常数减小 | |
| C. | 向氯水中加入CaCO3可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1HF溶液加水稀释,其电离平衡常数和$\frac{c({H}^{+})}{c(HF)}$均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| KW/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ,反应类型为取代反应或硝化反应;
,反应类型为取代反应或硝化反应;
 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)+H2(g)?CH3CH2CH2CH3(g)△H1
(g)+H2(g)?CH3CH2CH2CH3(g)△H1 (g)+H2(g)?CH3CH2CH2CH3(g)△H2
(g)+H2(g)?CH3CH2CH2CH3(g)△H2| 温度(℃) | 300 | 320 | 340 |
| K1 | 4.8×10-4 | 2.5×10-4 | 1.3×10-4 |
| K2 | 8.4×105 | 3.5×103 | 1.6×103 |
 (g)→
(g)→ (g)△H
(g)△H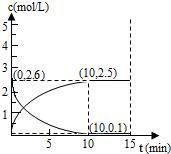
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com