
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径/10-10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
| 最低价态 | -1 | -2 | -4 | -3 | -1 | -3 | -1 |

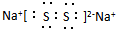 ,含有离子键、共价键,故答案为:离子键、共价键;
,含有离子键、共价键,故答案为:离子键、共价键; ;
;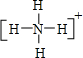 ,其中心N原子成4个N-H键,以sp3杂化轨道成键,故答案为:
,其中心N原子成4个N-H键,以sp3杂化轨道成键,故答案为: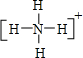 ;sp3;
;sp3;

 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
| A、58.5g NaCl晶体中含有NA个氯化钠分子 |
| B、标准状况下,33.6L CH2O含有的分子数为1.5NA |
| C、78g苯分子中含有的碳碳双键数目为3NA |
| D、含有23g乙醇的水溶液中氢原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,4.6g乙醇中含有C-H键的个数为0.6NA |
| B、一定温度下,15g甲醛和乙酸的混合物中O原子数为0.5NA |
| C、1mol Cl2和1mol H2O充分反应,生成的H+离子数为NA |
| D、标准状况下,11.2L庚烷完全燃烧后生成的CO2分子数为3.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 钴(Co)是一种重要的战略金属,钴及其合金广泛应用于电机、机械、化工、航空和航天等领域.钴在化合物中通常以+2、+3的形式存在.
钴(Co)是一种重要的战略金属,钴及其合金广泛应用于电机、机械、化工、航空和航天等领域.钴在化合物中通常以+2、+3的形式存在.查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 30 | 50 | 70 |
| H3BO3物质的量/mol | 1 | 0.8 | 0.4 |

| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8 mol |
| B、2.6 mol |
| C、2.4 mol |
| D、O.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液:K+、Cu2+、Br-、SO42- |
| B、含有0.1mol/LI-的溶液:NH3+、Fe3+、SO42-、Cl- |
| C、含有0.1mol/LHCO3-的溶液:Na+、Al3+、NO3-、OH- |
| D、强酸性溶液:K+、Mg2+、NO3-、ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com