
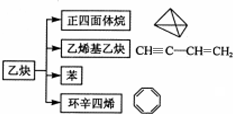
| A. | 图中五种有机物的实验式相同 | |
| B. | 乙炔生成乙烯基乙炔是加成反应 | |
| C. | 等质量的苯与乙烯基乙炔完全燃烧的耗氧量不同 | |
| D. |  与环辛四烯均能使溴水褪色 与环辛四烯均能使溴水褪色 |
分析 A.图中五种有机物的实验式相同,都为CH;
B.乙炔生成乙烯基乙炔,发生碳碳三键的加成反应;
C.苯与乙烯基乙炔的最简式均为CH;
D.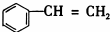 与环辛四烯均含碳碳双键.
与环辛四烯均含碳碳双键.
解答 解:A.实验式为最简式,乙炔分子式为C2H2,最简式为:CH,正四面体烷分子式为C4H4,最简式为:CH,乙烯基乙炔分子式为C2H2,最简式为:CH,苯分子式为C6H6,最简式为:CH,环辛四烯分子式为C8H8,最简式为:CH,图中五种有机物的实验式相同,故A正确;
B.乙炔生成乙烯基乙炔,发生碳碳三键的加成反应,故B正确;
C.苯与乙烯基乙炔的最简式均为CH,所以等质量的苯与乙烯基乙炔完全燃烧时的耗氧量相同,故C错误;
D.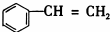 与环辛四烯均含碳碳双键,能和溴单质发生加成反应,所以均能使溴溶液褪色,故D正确;
与环辛四烯均含碳碳双键,能和溴单质发生加成反应,所以均能使溴溶液褪色,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的空间结构及官能团、性质的关系为解答的关键,侧重烯烃、炔烃性质的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 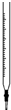 图为碱式滴定管,可盛装NaOH、KMnO4等溶液,不可盛装酸性液体 | |
| B. | 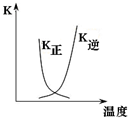 图中曲线表示反应2A(g)+B(g)═2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 | |
| C. | 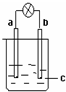 图中如果a是铁,b是碳,c是氯化铜溶液,则电流计指针偏转,且a变粗,b变细 | |
| D. | 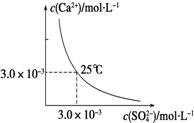 图表示25℃时,CaSO4在水中的沉淀溶解平衡曲线.向100 mL该条件下的CaSO4饱和溶液中加入100 mL 0.01mol•L-1的Na2SO4溶液有沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定溶液pH的操作:将pH试纸置于表面皿上,用蒸馏水润湿,再用洁净玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 测定空气中甲醛含量,使50mL注射器充满空气,通入到2mL2×10-4mol/L用硫酸酸化的高锰酸钾溶液中,重复前面的操作直到紫红色褪去,记录消耗空气体积,即可粗略测定空气中甲醛含量 | |
| D. | 做Al与CuSO4溶液的置换反应实验时,可将铝条直接插入CuSO4溶液中,观察铝片表面是否有铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
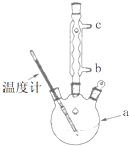 (1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略).
(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略). .
.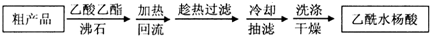
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
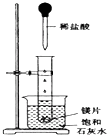 如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:
如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
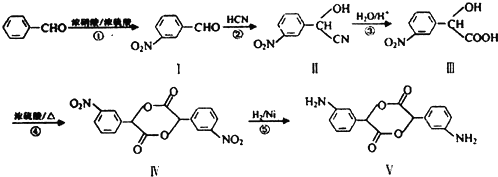
 和
和 .
.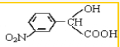 →
→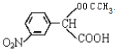 +H2O(不要求写出反应条件);用丙酮(
+H2O(不要求写出反应条件);用丙酮( 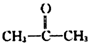 )代替化合物I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为CH3CHOH(CH3)COOH.
)代替化合物I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为CH3CHOH(CH3)COOH.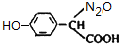 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com