
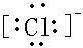 ,
,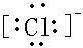 ;
;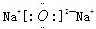 ,故答案为:
,故答案为: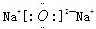 ;
;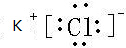 ,
,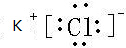 .
.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
 .现有分子式C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生下图所示的一系列反应:
.现有分子式C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生下图所示的一系列反应:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、整个反应过程中:c(H+)+c(Na+ )+c(NH4+)=c(OH-)+2c(SO42-) |
| B、滴入30mLNaOH溶液时(pH>7):c(NH4+)>c(NH3?H2O)>c(OH-)>c(H+) |
| C、当滴入20mLNaOH溶液时:2c(SO42-)=c(NH4+)+c(NH3?H2O) |
| D、当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有多种元素符合本题条件 |
| B、符合本题的HXROy 分子有一元酸和多元酸 |
| C、Z=X |
| D、R可能是第二周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | |
| Y | Z |
| A、X元素形成的单核阴离子还原性强于Y |
| B、Z元素氧化物对应水化物的酸性一定强于Y元素氧化物对应水化物 |
| C、X、Y、Z中氢化物稳定性最弱的是Y的氢化物 |
| D、Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2L |
| B、22.4L |
| C、33.6L |
| D、44.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2 |
| B、HCl |
| C、MgCl2 |
| D、Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:


 它的合成路线流程图合成路线流程图示例如下:CH3CH2OH
它的合成路线流程图合成路线流程图示例如下:CH3CH2OH| H2SO4 |
| 170℃ |
| H2 |
| 催化剂△ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com