
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
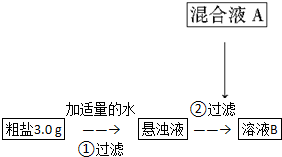
分析 无机融雪剂氯化钠、氯化钙、氯化镁中的镁离子可以用氢氧化钠进行检验,氯化钙可以用碳酸钠来检验,加入相应的试剂后,可以得到氯化钠的溶液;
(1)根据镁离子和钙离子的沉淀条件来选择合适试剂;
(2)检验溶液B中的Mg2+、Ca2+,根据沉淀看是否有沉淀来检验;
(3)根据氢氧化镁的Ksp=c(Mg2+)•c2(OH-)来计算即可;
(4)根据除杂的原则:能和杂反应同时不引进杂质离子,氢氧化钠和碳酸钠中的阴离子可以用氢离子来除去.
解答 解:无机融雪剂氯化钠、氯化钙、氯化镁中的镁离子可以用氢氧化钠进行检验,氯化钙可以用碳酸钠来检验,加入相应的试剂后,可以得到氯化钠的溶液;
(1)氯化镁中的镁离子可以用氢氧化钠进行检验,氯化钙可以用碳酸钠来检验,所以加入混合液A的主要成分是NaOH、Na2CO3,
故答案为:NaOH、Na2CO3;
(2)镁离子与强碱反应生成沉淀,可以用氢氧化钠检验镁离子,根据沉淀的溶度积数值的大小,数值越小,说明将钙离子沉淀需要的溶液的浓度越小,由于CaCO3的溶度积最小,检验Ca2+时选择Na2CO3沉淀效果最好,故效果最好的是碳酸钠溶液,选A,
故答案为:NaOH;A;
(3)加热能加快沉淀生成,根据氢氧化镁的Ksp=[Mg2+][OH-]2,所以[Mg2+]=$\frac{Ksp}{c{\;}^{2}(OH{\;}^{-})}$=$\frac{1.8×10-11}{(1{0}^{-2})^{2}}$=1.8×10-7mol•L-1,
故答案为:1.8×10-7mol•L-1 ;
(4)加热并不断滴加6mol•L-1的盐酸溶液,可以将溶液中多余的氢氧化钠和碳酸钠除去,
故答案为:除去NaOH和Na2CO3.
点评 本题是一道关于粗盐的提纯知识的综合实验题,难度较大,考查学生分析和解决问题的能力.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子序数为55 | B. | 电子数是55 | C. | 中子数是137 | D. | 质量数是137 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠浮在水面上,四处游动 | |
| B. | 反应放出的热量使得钠熔化成一个小球 | |
| C. | 反应完后烧杯中有蓝色不溶物 | |
| D. | 反应完后烧杯中出现红色不溶物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少对大气的污染 | B. | 降低成本 | ||
| C. | 防止石油短缺 | D. | 加大发动机的动力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数越大,原子半径一定越大 | |
| B. | 电子层数多的原子的半径一定比电子层数少的大 | |
| C. | 原子序数大的原子,最外层电子数越多 | |
| D. | 元素原子最外层电子数越多(除稀有气体),可显示的化合价不一定越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com