
| A. | 加催化剂,v正、v逆都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 | |
| C. | 降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数 | |
| D. | 增大氮气的浓度,v正增大、v逆不变,N2转化率减小,H2转化率增大 |
分析 A.催化剂同等程度改变化学反应速率,不影响化学平衡;
B.增大压强,正、逆反应速率都增大,平衡向体积减小的方向移动;
C.降低温度,正、逆反应速率都减小,平衡向放热反应方向移动;
D.增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变.
解答 解:A.催化剂能够同等程度改变正逆反应速率,故A正确;
B.加压,气体物质的量大的一边反应速率增大的倍数比气体物质的量小的一边增大倍数大,即v正增大的倍数大于v逆增大的倍数,故B正确;
C.降温,放热反应速率减小倍数小于吸热反应减小倍数,即v正减小的倍数小于v逆减小的倍数,故C错误;
D.增大反应物氮气的浓度,v正增大、v逆不变,平衡正向移动,N2转化率减小,H2转化率增大,故D正确,
故选C.
点评 本题考查化学平衡的影响因素,为高频考点,题目难度中等,本题易错点为D,注意增大氮气的浓度的时刻只改变反应物浓度,此时逆反应速率不变.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:解答题
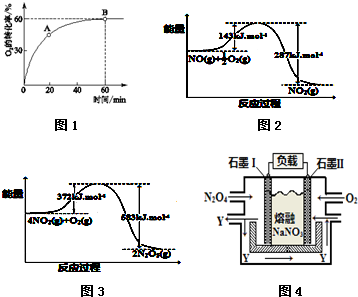
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA | |
| B. | 常温下,100mL 1mol•L-1 Na2CO3溶液中阴离子总数大于0.1NA | |
| C. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| D. | 将标况下22.4LC12通入足量NaOH溶液中充分反应转移电子数是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
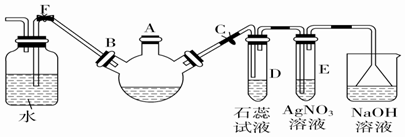
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
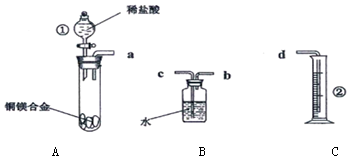
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、OH-、C1- | B. | Ba2+、K+、CO32-、NO3- | ||
| C. | Na+、K+、C1-、HCO3- | D. | H+、Na+、C1-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的体积之比为1:1 | B. | 它们所含氧原子数目之比为2:3 | ||
| C. | 它们的分子数目之比为1:1 | D. | 它们所含原子数目之比为3:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com