
| ���� | H2 | CO | CH3OH |
| Ũ�ȣ�mol/L�� | 0.2 | 0.1 | 0.4 |
| ��c |
| ��t |
| C(H2)?C(CO) |
| C(H2O) |
| 0.4mol/L |
| 10min |
| 0.4 |
| 0��22��0.1 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ͳ��� | ||||
B��
| ||||
| C����������� | ||||
| D����������춡�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ʹ��̪���ɫ����Һ��Na+��Ba2+��Cl-��NO3- |
| B��������C2H6��CO2��SO2��NO |
| C���Ȼ�����Һ��H+��K+��NO3-��I- |
| D�����������Һ��H+��Na+��SO42-�������Ƿ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
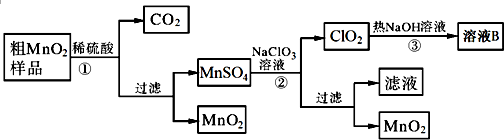
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��� | �������������/mL | �������Ƶ����/mL | ��Һ��pH |
| �� | 33.00 | 0.00 | 8 |
| �� | 33.00 | x | 7 |
| �� | 33.00 | 33.00 | 6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ҽ���Һ�м������ᡢ˫��ˮ��2I-+2H++H2O2�TI2+2H2O |
| B��CuƬ����FeCl3��Һ�У�Cu+Fe3+�TFe2++Cu2+ |
| C����Al2��SO4��3��Һ�м�������İ�ˮ��Al3++4NH3?H2O�TAlO2-+4NH4++2H2O |
| D���� NaHSO4��Һ�еμ�Ba��OH��2��Һ�����ԣ�H++SO42-+Ba2++OH-�TBaSO4��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ȼ�ϵ��������װ���ṩȼ�Ϻ������� |
| B��Mg��Alͨ�����Ȼ�ԭ�ķ�����ұ�� |
| C����ɫ��ѧ�ĺ�����Ӧ�û�ѧԭ���Ի�����Ⱦ�������� |
| D�������ʡ��������ۡ���֬�����ɸ߷�����ɵ����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com