
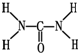
 氮元素可以形成多种化合物.
氮元素可以形成多种化合物.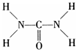 ,则尿素分子中C和N原子的杂化方式分别是
,则尿素分子中C和N原子的杂化方式分别是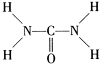 可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;
可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;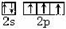 ,故答案为:
,故答案为: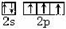 ;
; 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,

 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定有Al3+、SO42-,可能有K+、NH4+ |
| B、肯定无Fe2+、Mg2+、CO32-,可能有Al3+ |
| C、原溶液一定是明矾和MgSO4的混合溶液 |
| D、不能确定的离子只能通过焰色反应来确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两粒子的1s能级上的电子能量相同 |
| B、两粒子的3p能级上的电子离核的距离相同 |
| C、两粒子的电子发生跃迁时,产生的光谱不同 |
| D、两粒子都达8电子稳定结构,化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
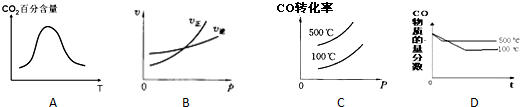
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com