
| A. | 可以采用多次盐析和溶解的方法分离提纯蛋白质 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性 | |
| C. | 肽键是蛋白质二级结构中的主键 | |
| D. | 用甘氨酸和丙氨酸缩合最多可以形成3种二肽 |
分析 A.蛋白质属于胶体,难溶于饱和盐溶液,不能透过半透膜;
B.蛋白质溶液中加入浓的硫酸铵溶液会使蛋白质盐析;
C.肽键是蛋白质结构中的一级结构;
D.氨基酸形成肽键原理为羧基提供-OH,氨基提供-H,两个氨基酸分子脱去一个水分子脱水结合形成二肽,既要考虑不同氨基酸分子间生成二肽,又要考虑同种氨基酸分子间形成二肽.
解答 解:A.蛋白质属于胶体,难溶于饱和盐溶液,不能透过半透膜,可用多次盐析或多次渗析的方法分离、提纯蛋白质,故A正确;
B.蛋白质溶液中加入浓的硫酸铵溶液会使蛋白质盐析,HCHO溶液能使蛋白质变性,故B错误;
C.蛋白质二级结构指它的多肽链中有规则重复的构象,限于主链原子的局部空间排列,不包括与肽链其他区段的相互关系及侧链构象,故C错误;
D.氨基酸生成二肽,就是两个氨基酸分子脱去一个水分子.当同种氨基酸脱水,生成2种二肽;当是异种氨基酸脱水:可以是甘氨酸脱去羟基,丙氨酸脱氢;也可以丙氨酸脱羟基,甘氨酸脱去氢,生成2种二肽,所以共有4种,故D错误.
故选A.
点评 本题考查蛋白质的结构、性质,物质的分离、提纯和鉴别,难度不大,D选项关键在于形成肽键既要考虑不同氨基酸分子间形成肽键,又要考虑同种氨基酸分子间形成肽键.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:选择题
| A. | C14H18O5 | B. | C14H16O4 | C. | C16H22O5 | D. | C16H20O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
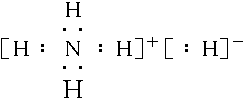 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于水中存在氢键,所以水很稳定 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | Na2O2中既含有离子键,又含有非极性键 | |
| D. | 由于C═O键是极性键,所以CO2是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
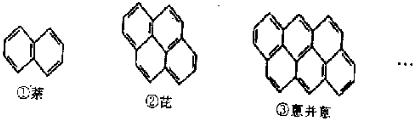
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com