
【题目】某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如右图所示,下列说法中不正确的是
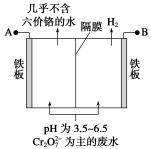
A.A为电源正极
B.阴极区附近溶液pH降低
C.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原
【答案】B
【解析】
试题分析:A、B极上产生氢气,其电极反应式:2H++2e-=H2↑,依据电解的原理,B电极是阴极,A电极是阳极,与电源正极相连,A正确;B、阴极电极反应式:2H2O + 2e- = H2↑ + 2OH-,溶液的pH增大,B错误;C、阳极铁作电极,Fe-2e-=Fe2+,利用Fe2+具有还原性+2价→+3,Cr2O72-具有氧化性+6→+3,最小公倍数是6,依据原子守恒,得出离子反应方程式:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,C正确;D、依据B选项的分析,产生6.72L的氢气,转移电子![]() =1.2mol,同时生成Fe2+物质的量1.2 mol ÷ 2 = 0.6mol,根据C选项的方程式得出有0.1molCr2O72-被还原,D正确,答案选B。
=1.2mol,同时生成Fe2+物质的量1.2 mol ÷ 2 = 0.6mol,根据C选项的方程式得出有0.1molCr2O72-被还原,D正确,答案选B。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于丙烯(CH3—CH =CH2)的说法正确的
A.丙烯分子中3个碳原子都是sp3杂化
B.丙烯分子存在非极性键
C.丙烯分子有6个σ键,1个π键
D.丙烯分子中3个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)是一种空间网状结构,硬度大熔点高的透明材料,描述正确的是( )
A.含有离子键
B.属于原子晶体
C.既有离子键又有共价键
D.属于离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定100mL浓度均为O.1mol/L的三种酸(HM、HN和HR)溶液,滴定的曲线如图所示,下列判断错误的是
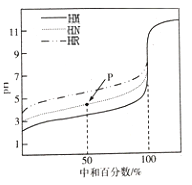
A. 三种酸的电离常数关系:KHM>KHN>KHR
B. pH=7时,三种溶液中:c(M-)>c(N-)>c(R-)
C. 当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR)=c(OH-)-c(H+)
D. 滴定至P点时,溶液中:c(HN)>c(N-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的价电子排布式为_________。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C___Ti(填“>”或“<“,下同);第一电离能:N____O,原因是_________ 。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为___形,其中硫原子的杂化方式为_______,写出与SO42-互为等电子体的一种分子的化学式:________。
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图1,Ti位于立方体的体心。该晶体中,Ca2+的配位数为__。

(5)Fe能形成多种氧化物,其中FeO晶胞结构如图2。FeO晶胞边长为428pm则FeO晶体的密度为____g/cm3(阿伏伽德罗常数的值用NA表示,1pm=10-12m,写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 100 mL 0.2 mol·L-1蔗糖溶液中所含分子总数为0. 02 NA
B. 40 mL 10 mol·L-1的浓盐酸与足量的MnO2充分反应,生成氯气的分子数为0.1 NA
C. 标准状况下,22.4 L CHCl3中含有的氯原子数目为3 NA
D. 14 g CO和N2混合气体中含有的电子总数为7 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关除杂方法正确的是
A. 除去Fe3+中Al3+:加入过量氨水充分反应后,过滤
B. 除去FeCl3中少量CuCl2:加入足量铁粉,过滤
C. 除去NaHCO3溶液中的Na2CO3:通入过量CO2充分反应
D. 除去铝粉中的镁粉:加入足量的氢氧化钠溶液后,过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com