
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为____________。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反应的离子方程式为_____________________。
(2)电镀厂的废水中含有的CN-有剧毒,需要处理加以排放。处理含CN-废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_____________。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子):
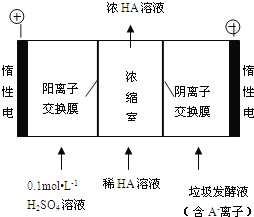
①阳极的电极反应式为________________________。
②简述浓缩室中得到浓乳酸的原理:________________________。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 g/L 乳酸溶液通电一段时间后,浓度上升为145 g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为________L(提示:乳酸的摩尔质量为90 g/mol)。
【答案】第四周期第ⅤA族2H3AsO3+3S2-+6H+═As2S3↓+6H2O4H2O+2CN-+O2═2HCO3-+2NH32H2O-4e-═4H++O2↑阳极H2O放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-从阴极通过阴离子交换膜进入浓缩室,H++A-═HA,乳酸浓度增大6.72
【解析】
(1)①砷原子电子层数=周期数=4,最外层电子数=族序数=5,所以砷位于第四周期第ⅤA族;因此本题答案是:第四周期第ⅤA族。
②根据信息:硫化钠可以和废水中的砷反应,生成难溶性的三硫化二砷,据此得到反应的离子方程式为:2H3AsO3+3S2-+6H+═As2S3↓+6H2O;因此,本题答案是:2H3AsO3+3S2-+6H+═As2S3↓+6H2O。
(2)CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为:4H2O+2CN-+O2═2HCO3-+2NH3;因此,本题答案是:4H2O+2CN-+O2═2HCO3-+2NH3。
(3) ①阳极上是氢氧根离子失电子发生氧化反应,电极反应式为:2H2O-4e-═4H++O2↑ ;因此本题答案是:2H2O-4e-═4H++O2↑。
②在电解池的阳极上是氢氧根放电,所以c(H+)增大,并且H+从阳极通过阳离子交换膜进入浓缩室;根据电解原理,电解池中的阴离子移向阳极,即 A-通过阴离子交换膜从阴极进入浓缩室,发生反应:H++A-═HA,使乳酸浓度增大;综上所述,本题答案是:阳极H2O放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-从阴极通过阴离子交换膜进入浓缩室,H++A-═HA,乳酸浓度增大。
③在阳极上发生电极反应:4OH—-4e-=2H2O+O2↑,阴极上发生电极反应:2H++2e-=H2↑,根据电极反应方程式,则有:HA—H+--1/2H2,据差值法,乳酸的浓度变化量是(145-10)/90=1.5mol/L,即生成HA的物质的量是1.5×0.4=0.6mol,即产生氢气0.3mol,即0.3×22.4=6.72L;综上所述,本题答案是:6.72L。


科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1)甲组同学取l0mL0.l mol·L-1KI溶液,加入6 mL0.l mol·L-1 FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入lmLCCl4充分振荡、静置, CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀:
③第三支试行中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号) ______________;实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号)_______________,由此可以证明该氧化还原反应为___________________(填可逆反应或不可逆反应)。
(2)乙组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__________________________________;生成沉淀的原因是(用平衡移动原理解释)_________________________________________________。
(3)丙组同学模拟工业上用NaClO3氧化酸性FeCl2废液制备FeCl3。
①若酸性FeCl2 废液中:c(Fe2+)=2.0×10-2 mol·L-1,c(Fe3+)=1.0×10-3 mol·L-1,c(Cl-)=5.3×10-2 mol·L-1,则该溶液的pH约为_____________。
②完成NaClO3氧化FeCl2的离子方程式:□ClO3-+□Fe2++□________=□Cl-+□Fe3++□________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C(s,石墨)=C(s,金刚石) H>0,下列判断正确的是( )
A.此反应为放热反应
B.断裂1mol石墨的化学键需要吸收的能量小于生成1mol金刚石化学键所放出的能量
C.石墨比金刚石稳定
D.此变化为物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间。以下叙述正确的是( )

A. 两烧杯中铜片表面均有气泡产生
B. 甲烧杯中的电流与阳离子流向均为Zn→Cu
C. 两烧杯中溶液的pH均增大
D. 两烧杯在相同时间内转移电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酞的结构简式如图,下列关于酚酞的说法一定正确的是
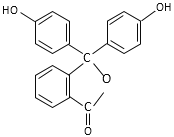
A. 酚酞的分子式是C20H12O4
B. 分子中的碳原子不在同一平面
C. 1 mol酚酞最多可消耗2 mol NaOH
D. 常温下,由水电离的c(H+)=10-13mol·L-1的溶液中滴入酚酞试液后,溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质的变化规律与分子间作用力有关的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、Nal的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知:氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。活泼金属硫化物与酸反应产生H2S气体。
Ⅰ、制备氢化锂:选择下图中的装置制备氢化锂(有些装置可重复使用):

(1)装置的连接顺序(从左至右)为A→___________________________________。
(2)检查好装置的气密性,打开装置A中分液漏斗的活塞后,点燃酒精灯前需进行的实验操作是________。
Ⅱ、制备氢化铝锂
1947年,Schlesinger、Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)写出氢化锂与无水三氯化铝反应的化学方程式_________________________。
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度
(4)按下图连接好装置后,检查装置气密性的操作是:_____________________。装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是__________________。

(5)在标准状况下,反应前量气管(由碱式滴定管改装而成)读数为V1 mL,反应完毕并冷却之后,量气管读数为V2 mL。该样品的纯度为_________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是_____。

(2)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量,已知(见图):则1mol N﹣H键断裂吸收的能量约等于_____kJ。

(3)请将 Zn+2Ag+=2Ag+Zn2+设计成原电池,并画出简易装置图,并注明电极材料以及电解质溶液___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com