
【题目】某实验室产生的废液中含有Fe3+、Cu2+、Ba2+三种金属离子,研究小组设计了下列方案对废液进行处理,以回收金属,保护环境。

请回答:
(1)步骤①②④用到的主要玻璃仪器是___________________。
(2)步骤③的实验现象是_________________。
(3) 设计一个实验方案,验证步骤①中所加硫酸溶液己经过量____________________。
【答案】 玻璃棒、漏斗、烧杯 溶液由浅绿色变为黄色 取上层清液,继续加硫酸,若无产生白色沉淀,则说明硫酸已加过量
【解析】考查化学工艺流程,(1)根据流程,步骤①②④为过滤,用到玻璃仪器为漏斗、烧杯、玻璃棒;(2)步骤③利用H2O2的氧化性,把Fe2+氧化成Fe3+,发生反应是2Fe2++H2O2+2H+=2Fe3++2H2O,现象溶液颜色由浅绿色转变为黄色;(3)步骤①发生Ba2++SO42-=BaSO4↓,溶液中含有H+,因此不能鉴别H+存在,因此需要鉴别SO42-或Ba2+,操作是:取上层清液,继续加入硫酸,若不产生白色沉淀,则说明硫酸过量,或者取上层清液,加入BaCl2溶液,如果有白色沉淀,说明硫酸过量。


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】—种微生物燃枓电池如图所示,下列关于该电池说法正确的是:

A. a电极为正极
B. H+由右室通过质子交换膜进入左室
C. a电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
D. 当b电极上产生lmolN2时,溶液中将有l0mole-通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 ![]() 和
和![]() 是钍的两种同位素,
是钍的两种同位素,![]() 可以转化成
可以转化成![]() 。下列有关 Th 的说法正确的是( )
。下列有关 Th 的说法正确的是( )
①Th 元素的质量数是 232 ②![]() 和
和![]() 的化学性质相同 ③
的化学性质相同 ③![]() 转换成
转换成![]() 是化学变化 ④Th 元素的相对原子质量是 231 ⑤
是化学变化 ④Th 元素的相对原子质量是 231 ⑤![]() 和
和 ![]() 具有相同的最外层电子数
具有相同的最外层电子数
A.①②B.③④C.②⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A 是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2 ![]() 2CH3COOH。F 是高分子化合物。现以 A 为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。F 是高分子化合物。现以 A 为主要原料合成乙酸乙酯,其合成路线如下图所示。

回答下列问题:
(1)A 的电子式为______,结构简式为_______。
(2)B、D 分子中的官能团名称分别是_______、_______。
(3)反应①~⑤的反应属于取代反应的是:_____。
(4)写出下列反应的化学方程式:①_____、④______、⑤_______。
(5)下列物质中,可以通过 A 加成反应得到的是_____(填序号)。
A.CH3CH3
B.CH3CHCl2
C.CH3CH2OH
D.CH3CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32 -、SO42 -、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32 -和SO42 -,一定不存在Fe3+
B. 是否存在Na+只有通过焰色反应才能确定
C. 原溶液一定存在Na+,可能存在Cl-
D. 若原溶液中不存在Cl-,则c (Na+) =0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.5 mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出320.8 kJ的热量。
(1)肼的电子式为___________________,过氧化氢的电子式为__________________。
(2)写出反应的热化学方程式:________________________________________________。
(3)在25 ℃、101 kPa时,已知18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:
O===O | H—H | H—O(g) | |
1 mol化学键断裂时 需要吸收的能量/kJ | 496 | 436 | 463 |
写出表示H2燃烧热的热化学方程式___________________________________________;则32 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________kJ。
(4)联氨和H2O2可作为火箭推进剂的主要原因为_________________________________。
(5)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为____________(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_______________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:

已知Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写两种):___________;___________。
(2)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn全部转化为MnO2),请配平下列除去Fe2+的离子方程式:MnO![]() +Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________
+Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________
(3)加入锌粉的目的是_______________________________________________________。
(4)已知H2SO4浸出液中,c(Fe2+)=5.04 mg·L-1、c(Mn2+)=1.65 mg·L-1,加入KMnO4溶液反应一段时间后,溶液中c(Fe3+)=0.56 mg·L-1,若溶液pH=3,则此时Fe3+__________(填“能”或“不能”)生成沉淀。
(5) 已知:常温下,①Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。

①比较H2R ,HR-,H2CO3三者的酸性强弱_________________________________
②NaHR溶液中存在![]() = _______________________
= _______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:

已知:
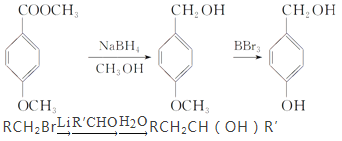
根据以上信息回答下列问题:
(1)白藜芦醇的分子式是________。
(2)C→D的反应类型是_________;E→F的反应类型是________。
(3)化合物A不与FeCL3溶液发生显色反应,能与NaHCO3反应放出CO2,推测其核磁共振氢谱(1H-NMR)中显示有_______种不同化学环境的氢原子,其个数比为_______。
(4)写出A![]() B反应的化学方程式_______
B反应的化学方程式_______
(5)写出化合物D、E的结构简式:D_______,E_______。
(6)化合物![]() 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:______。
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:______。
①能发生银镜反应;②含苯环县苯环上只有两种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将氯化铝溶液蒸干灼烧得到的固体物质是(填化学式)____________向纯碱溶液中滴入几滴酚酞会变红,原因是(用离子方程式表示)_______________ 。
(2)牙齿表面由一层坚硬的、组成为Ca5(PO4)3OH的物质保护着。它在唾液中存在下列平衡:Ca5(PO4)3OH(s)![]() 5Ca2++3PO43-+OH-。进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是_____________________________________________。
5Ca2++3PO43-+OH-。进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是_____________________________________________。
(3)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为_________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com