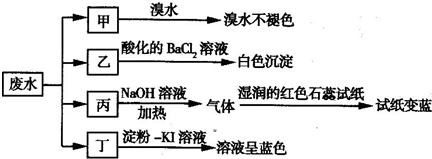
某溶液甲中可能含有下列离子中的几种:K+、NO3-、SO42-,、NH4+、CO32-(不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
(1)甲溶液中一定存在的离子是______;
(2)甲溶液中一定不存在的离子是______;
(3)甲溶液中可能存在的离子是______;你得出此结论的理由是______.
解:(1)根据实验1:第一份加入足量的烧碱并加热,因NH
4++OH
-=NH
3↑+H
2O,会产生标准状况下为224mL气体,证明含有NH
4+,且物质的量为0.01mol;
实验2:第二份先加入足量的盐酸,无现象,则一定不含有CO
32-,再加足量的BaCl
2溶液,得固体2.33g,证明一定含有SO
42-,且物质的量为:n=

=
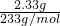
=0.01mol;根据溶液中的电荷守恒,溶液呈电中性,则一定含有钾离子,且钾离子的浓度≥
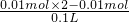
═0.1mol/L,所以该溶液中肯定含有NH
4+、S0
42-、K
+,
故答案为:K
+、NH
4+、S0
42-;
(2)实验2:第二份先加入足量的盐酸,无现象,则不含有CO
32-,如果有CO
32-,CO
32-+2H
+=H
2O+CO
2↑,会有二氧化碳气体产生,故答案为:CO
32-;
(3)根据(1)知:钾离子的浓度≥
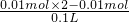
=0.1mol/L,如果K
+的物质的量等于0.01mol,则不含NO
3-,如果K
+的物质的量大于0.01mol,则还应含有NO
3-,
故答案为:NO
3-;由题意知,NH
4+物质的量为0.01mol,SO
42-物质的量为0.01mol,根据溶液呈电中性原理,应该含有K
+,如果K
+的物质的量等于0.01mol,则不含NO
3-,如果K
+的物质的量大于0.01mol,则还应含有NO
3-.
分析:实验1:第一份加入足量的烧碱并加热会产生在标准状况下为224mL气体证明含有NH
4+,且物质的量为0.01mol;
实验2:第二份先加入足量的盐酸,无现象,则不含有CO
32-,再加足量的BaCl
2溶液,得固体2.33g,证明含有SO
42-.,且物质的量为0.01mol,根据溶液呈电中性原理,判断是否含有NO
3-,据此即可解答.
点评:本题考查了溶液中成分的鉴别,依据物质的性质注意离子之间的反应以及现象是解答的关键,题目难度不大.

 =
=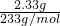 =0.01mol;根据溶液中的电荷守恒,溶液呈电中性,则一定含有钾离子,且钾离子的浓度≥
=0.01mol;根据溶液中的电荷守恒,溶液呈电中性,则一定含有钾离子,且钾离子的浓度≥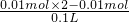 ═0.1mol/L,所以该溶液中肯定含有NH4+、S042-、K+,
═0.1mol/L,所以该溶液中肯定含有NH4+、S042-、K+,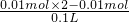 =0.1mol/L,如果K+的物质的量等于0.01mol,则不含NO3-,如果K+的物质的量大于0.01mol,则还应含有NO3-,
=0.1mol/L,如果K+的物质的量等于0.01mol,则不含NO3-,如果K+的物质的量大于0.01mol,则还应含有NO3-,