
| A、Zn、Ag |
| B、Cu、Fe |
| C、Al、Fe |
| D、Mg、Al |
| m |
| n |
| 11.2L |
| 22.4L/mol |
| 15 |
| 0.5 |
| 2 |
| 3 |
| 2 |
| 3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、0.1 mol H2O中含有电子的数目为NA |
| C、标准状况下,11.2L四氯化碳中含有分子的数目为0.5NA |
| D、0.5 mol?L-1 CaCl2溶液中的Cl-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH、AlCl3 |
| B、CuSO4、BaCl2 |
| C、NaAlO2、HCl |
| D、MgCl2、AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
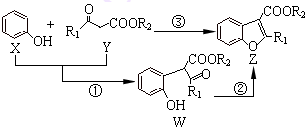
| A、反应①属于加成反应 |
| B、W中至少含有1个手性碳原子 |
| C、X、Y、W、Z这四种物质中最多有三种能与NaOH溶液反应 |
| D、可用溴水或FeCl3溶液鉴别出X和W |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用坩埚灼烧MgCl2?6H2O的反应式:MgCl2?6H2O
| ||||
| B、在0.1mol?L-1 Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) | ||||
| C、常温下,将PH=2的稀硫酸稀释10倍,其中各离子的浓度都变为原来的十分之一 | ||||
| D、蛋白质肽链中-NH-上的氢原子与羰基上的氧原子形成氢键是蛋白质二级结构的主要依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:
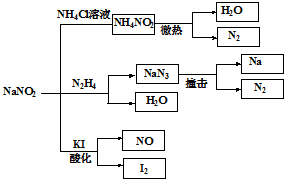 亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )
亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )| A、NH4NO2的热稳定性大于NaNO2 |
| B、NaN3分解,每产生1molN2转移6mole- |
| C、NaN3可用氨基钠(NaNH2)和N2O在液氨中低温制备,N2O与N3-互为等电子体 |
| D、可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500s内N2O5分解速率为2.96×10-3 mol/(L?s) |
| B、T1温度下的平衡常数为K1=125,1000s时转化率为50% |
| C、其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 |
| D、T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若T1>T3,则K1>K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2(g)的燃烧热是285.8 kJ?mol-1,则H2O(g)=2H2(g)+O2(g)△H=+285.8 kJ?mol-1 |
| B、对于反应2H2O2═2H2O+O2↑,升高温度能加快O2的生成速率 |
| C、已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| D、在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl-?[CuCl4]2-(绿)+4H2O,若向溶液中滴加足量AgNO3溶液,可使溶液呈现绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com