
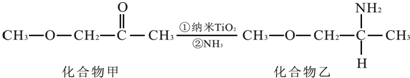
 ,其原子核外共有22种运动状态不相同的电子.
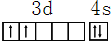
,其原子核外共有22种运动状态不相同的电子.分析 (1)Ti原子价电子为3d、4s电子,3d能级上有2个电子、4s能级上有2个电子;原子核外有几个电子其电子就有几种运动状态;
(2)价层电子对个数=σ键个数+孤电子对个数,根据价层电子对互斥理论确定其空间构型,据此分析解答;
(3)单键中含有1个σ键,双键中含有1个σ键和1个π键;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;氢键的存在导致物质熔沸点升高;
(4)配合物质含有孤电子对的微粒作配体;分子晶体的熔沸点较低;Fe(CO)5受紫外线照射时,发生反应生成九羰基二铁和CO;
(5)Fe单质晶体中原子的空间利用率为68%,为体心立方密堆积,则晶体中Fe原子的配位数为8;根据ρ=$\frac{m}{V}$计算.
解答 解:(1)Ti原子价电子为3d、4s电子,3d能级上有2个电子、4s能级上有2个电子,其价电子排布图为 ;原子核外有几个电子其电子就有几种运动状态,Ti原子核外有22个电子,所以其原子核外电子有22种运动状态;
;原子核外有几个电子其电子就有几种运动状态,Ti原子核外有22个电子,所以其原子核外电子有22种运动状态;
故答案为: ;22;
;22;
(2)NH3的中心原子的价层电子对数为3+$\frac{1}{2}$(5-1×3)=4,含有1个孤电子对,所以分子的空间构型为三角锥形;
故答案为:4;三角锥形;
(3)单键中含有1个σ键,双键中含有1个σ键和1个π键,所以1mol化合物甲中含有的σ键数目为13NA;氢键的存在导致物质熔沸点升高,乙中含有氢键、甲不含氢键,所以化合物乙熔沸点高于甲;能形成sp3杂化的原子有C、N、O元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能N>O>C,
故答案为:13NA;N>O>C;化合物乙分子间形成氢键;
(4)配合物质含有孤电子对的微粒作配体,所以配合物五羰基铁[Fe(CO)5]的配位体是CO;Fe(CO)5为黄色液体,易溶于非极性溶剂,熔沸点较低,所以属于分子晶体;Fe(CO)5受紫外线照射时,发生反应生成九羰基二铁和CO,其反应的方程式为:2Fe(CO)5=Fe2(CO)9+CO;
故答案为:CO;分子晶体;2Fe(CO)5=Fe2(CO)9+CO;
(5)Fe单质晶体中原子的空间利用率为68%,为体心立方密堆积,则晶体中Fe原子的配位数为8;其晶胞图为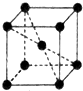 ,Fe的原子半径为apm=10-10acm,设晶胞棱长为xcm,则3x2=(4×10-10a)2,故x=$\frac{4\sqrt{3}}{3}$a×10-10cm,晶胞中Fe原子数目为1+8×$\frac{1}{8}$=2,晶胞质量为$\frac{2×56}{{N}_{A}}$g,
,Fe的原子半径为apm=10-10acm,设晶胞棱长为xcm,则3x2=(4×10-10a)2,故x=$\frac{4\sqrt{3}}{3}$a×10-10cm,晶胞中Fe原子数目为1+8×$\frac{1}{8}$=2,晶胞质量为$\frac{2×56}{{N}_{A}}$g,
则晶体密度为:$\frac{2×56}{{N}_{A}}$g÷($\frac{4\sqrt{3}}{3}$a×10-10cm)3=$\frac{{21\sqrt{3}}}{{4{a^3}{N_A}×{{10}^{-30}}}}$g/cm3,
故答案为:体心立方;8;$\frac{{21\sqrt{3}}}{{4{a^3}{N_A}×{{10}^{-30}}}}$.
点评 本题是对物质结构知识的综合考查,涉及核外电子排布、氢键、晶体类型的判断、晶胞计算等,(5)为易错点、难点,需要学生熟练掌握金属晶胞结构,具备一定的数学计算能力,难度中等.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
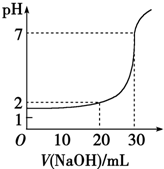 如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )
如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )| A | B | C | D | |
| c(HCl)/mol•L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
| c(NaOH)/mol•L-1 | 0.04 | 0.12 | 0.09 | 0.03 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.
乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
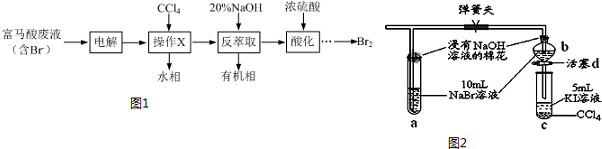
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放热反应不一定不需要加热,但吸热反应一定需要加热 | |
| B. | 中和反应都是放热反应 | |
| C. | 氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量低 | |
| D. | C与CO2反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
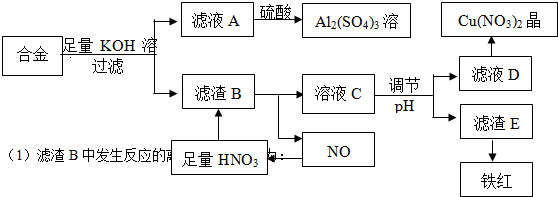
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com