
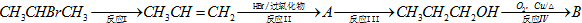 请回答下列问题:
请回答下列问题:分析 CH3CH=CH2与HBr发生加成反应生成A,A水解生成CH3CH2CH2OH,可知A应为CH3CH2CH2Br,CH3CH2CH2OH发生催化氧化可生成CH3CH2CHO,结合对应物质的性质以及题目要求解答该题.
解答 解:CH3CH=CH2与HBr发生加成反应生成A,A水解生成CH3CH2CH2OH,可知A应为CH3CH2CH2Br,CH3CH2CH2OH发生催化氧化可生成CH3CH2CHO,
(1)由以上分析可知A为CH3CH2CH2Br,B为CH3CH2CHO,故答案为:CH3CH2CH2Br;CH3CH2CHO;
(2)由以上分析可知CH3CH=CH2与HBr发生加成反应生成A,CH3CH2CH2OH发生催化氧化可生成CH3CH2CHO,故答案为:加成反应;氧化反应;
(3)卤代烃在NaOH的醇溶液,加热条件下发生消去反应生成烯烃,故答案为:NaOH的醇溶液,加热;
(4)涉及反应为CH3CHBrCH3+NaOHH$→_{△}^{醇}$CH3CH=CH2+NaBr+H2O;CH3CH=CH2+HBr$\stackrel{过氧化物}{→}$CH3CH2CH2Br;CH3CH2CH2Br+NaOH$→_{△}^{H_{2}O}$CH3CH2CH2OH+HBr;
2CH3CH2CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CH2CHO+2H2O,
故答案为:CH3CHBrCH3+NaOHH$→_{△}^{醇}$CH3CH=CH2+NaBr+H2O;CH3CH=CH2+HBr$\stackrel{过氧化物}{→}$CH3CH2CH2Br;CH3CH2CH2Br+NaOH$→_{△}^{H_{2}O}$CH3CH2CH2OH+HBr;2CH3CH2CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CH2CHO+2H2O.
点评 本题考查有机物推断,为高考常见题型,涉及有机反应类型、有机反应方程式的书写等知识,重点考查了卤代烃发生消去反应这一性质,解题的关键是根据反应的条件确定反应的类型及产物,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 位于第四周期、第ⅠA 族 | |
| B. | 氢氧化铷是弱碱 | |
| C. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| D. | 硝酸铷是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 _.
_.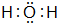 (填该物质的电子式).
(填该物质的电子式).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | Al2O3的熔点很高,可用于制作耐高温材料 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②⑥ | B. | 只有①⑤⑥ | C. | 只有③⑥ | D. | 只有①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H2O=4NaOH+O2 | B. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl | ||
| C. | Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ | D. | NH4Cl+NaOH=NaCl+H2O+NH3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
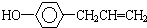 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A. | 该有机物所有原子均可在同一平面上 | |
| B. | 1mol该有机物最多可与4mol溴发生反应 | |
| C. | 该有机物核磁共振氢谱有6组峰,峰面积比为1:1:2:2:2:2 | |
| D. | 该有机物在水中的溶解度大于苯酚在水中的溶解度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com