
【题目】在一定温度下,二氧化硫与氧气反应的热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1。现向5 L的恒容密闭容器中充入1.0 mol SO2和0.5 mol O2气体,反应一段时间后达到平衡,恢复到原温度,测得此过程中体系向外界共释放了78.4 kJ的热量。下列说法正确的是 ( )
2SO3(g) ΔH=-196 kJ·mol-1。现向5 L的恒容密闭容器中充入1.0 mol SO2和0.5 mol O2气体,反应一段时间后达到平衡,恢复到原温度,测得此过程中体系向外界共释放了78.4 kJ的热量。下列说法正确的是 ( )
A. 上述反应达到平衡时,二氧化硫和氧气的转化率都是20%
B. 上述反应达到平衡后,向容器中充入1.0 mol Ar,平衡正向移动
C. 起始时向容器中充入1.0 mol SO3,保持温度不变,达到平衡时共吸收19.6 kJ的热量
D. 起始时向容器中充入2.0 mol SO3、0.5 mol SO2和0.25 mol O2,反应达到平衡前v正<v逆
【答案】C
【解析】设参加反应的二氧化硫和氧气的物质的量分别是xmol、ymol ,
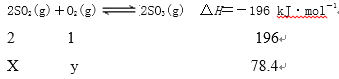
![]() 、
、 ![]() ,x=0.8 y=4 ,二氧化硫的转化率是
,x=0.8 y=4 ,二氧化硫的转化率是![]() ,二氧气的转化率
,二氧气的转化率![]() ,故A错误;向容器中充入1.0 mol Ar,反应物浓度不变,平衡不移动,故B错误;根据等效平衡原理,起始时向容器中充入1.0 mol SO3,保持温度不变,充入1.0 mol SO2和0.5 mol O2气体是等效平衡,达到平衡时二氧化硫的物质的量都是0.2mol,吸收19.6 kJ的热量,故C正确;该反应的动平衡时,含有0.8 mol SO3、0.2 mol SO2和0.1 mol O2,K=
,故A错误;向容器中充入1.0 mol Ar,反应物浓度不变,平衡不移动,故B错误;根据等效平衡原理,起始时向容器中充入1.0 mol SO3,保持温度不变,充入1.0 mol SO2和0.5 mol O2气体是等效平衡,达到平衡时二氧化硫的物质的量都是0.2mol,吸收19.6 kJ的热量,故C正确;该反应的动平衡时,含有0.8 mol SO3、0.2 mol SO2和0.1 mol O2,K=![]() =160 , 起始时向容器中充入2.0 mol SO3、0.5 mol SO2和0.25 mol O2,
=160 , 起始时向容器中充入2.0 mol SO3、0.5 mol SO2和0.25 mol O2,![]() =64,
=64,![]() , v正>v逆,故D错误。
, v正>v逆,故D错误。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知723K时,2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
A.Q2=![]() B.Q2>
B.Q2>![]() C.Q2<Q1<Q D.Q=Q1>Q2
C.Q2<Q1<Q D.Q=Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学电源的叙述,错误的是( )
A. 化学电源均是根据原电池的工作原理设计的
B. 在干电池中,碳棒只起导电作用,并不参加化学反应
C. 镍镉电池不能随意丢弃的原因是镍、镉的资源有限,价格昂贵
D. 燃料电池是一种高效、环保的新型化学电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,能长时间保持稳定的放电电压。其电池总反应为:3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-= Zn(OH)2
B. 充电时阳极发生氧化反应,附近溶液碱性增强
C. 充电时每转移3mol电子,阴极有1.5molZn生成
D. 放电时正极反应为:FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:

(1)图中A、C分别表示 、 ,
E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
、
;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1
,则υ(O2)= mol·L-1·min-1、
υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,求由S(s)生成3 molSO3(g)的△H= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2 L氯气所含有的原子数目为NA
B.9 g水所含有的氢原子数目为NA
C.在同温同压时, 相同物质的量的任何气体的体积相同且为11.2L
D.1 mol NH4+ 所含质子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
A.58.5 g氯化钠固体中含有![]() 个氯化钠分子
个氯化钠分子
B.1 mol Fe参与反应失去电子数目一定为2![]()
C.1 molNa被完全氧化生成Na202,失去2![]() 个电子
个电子
D.常温下,46 g N02和N204的混合物中含有的氮原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.lmol·L-1NH4HSO4溶液中滴入0.1mol·L-1NaOH溶液,溶液中由水电离出的c水(H+)与所加NaOH溶液的体积的关系如图所示。下列分析正确的是

A. b点时,溶液的pH=7
B. 常温下,Kb(NH3·H2O)=1.0×10-5.3
C. Vd<30 mI
D. e点溶液中粒子浓度由大到小的顺序为c(Na+)>c(SO42-)>c(NH4+)>c(NH3·H2O )>c(OH- )>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com