
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
分析 (1)氧化还原反应中元素化合价有升价就有降价且升价降价相等,再结合元素守恒可得;
(2)焙烧时MgO未反应,焙烧后的固体加水浸取,分离得到固体A为Fe2O3、MgO;
(3)加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-.
(4)①由表可知,温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,低温下得到溶解度更小的物质;
②利用溶解度不同,温度对溶解度影响分析;
(5)固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,为精确分析B中氢氧化铝含量,先利用氢氧化铝的两性,用过量的氢氧化钠溶液溶解氢氧化铝,过滤除去不溶物,向滤液中通入二氧化碳重新生成氢氧化铝沉淀,灼烧得到氧化铝固体,根据铝元素守恒计算样品中氢氧化铝的质量,进而计算其质量分数.
解答 解:(1)反应中Fe、Cr元素化合价升高,方程需要降价的元素,又反应后有氧原子,反应前也应该有,则缺陷物质为氧气,Fe元素化合价由+2价升高为+3价,Cr元素化合价由+3价升高为+6价,总升高+7价,O元素化合价由0价降低为-2价,共降低4价,化合价升降最小公倍数为28,故FeO•Cr2O3的系数为4,氧气系数为7,再根据原子守恒配平后方程式为:4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2;
故答案为:4;8;7O2;8;2;8;
(2)焙烧时MgO未反应,焙烧后的固体加水浸取,分离得到固体A为Fe2O3、MgO;
故答案为:Fe2O3、MgO;
(3)由于存在反应平衡2CrO42-+2H+?Cr2O72-+H2O,加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-;
故答案为:由于存在反应平衡2CrO42-+2H+?Cr2O72-+H2O,加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-;
(4)①由图可知:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应在低温下可以得到重铬酸钾;
故答案为:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应在低温下可以得到重铬酸钾;
②加入KCl固体后,利用溶解度不同,温度对溶解度影响,再经过加热浓缩、冷却结晶、过滤、洗涤、干燥可以得到K2Cr2O7晶体;
故答案为:加热蒸发;冷却结晶;
(5)固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,为精确分析B中氢氧化铝含量,先利用氢氧化铝的两性,用过量的氢氧化钠溶液溶解氢氧化铝,过滤除去不溶物,向滤液中通入二氧化碳重新生成氢氧化铝沉淀,灼烧得到氧化铝固体,
根据Al元素守恒,样品中氢氧化铝的质量分数=$\frac{mg÷102g/mol×2×78g/mol}{ng}$=$\frac{26m}{17n}$;
故答案为:氢氧化钠溶液;$\frac{26m}{17n}$.
点评 本题考查物质制备、物质含量测定、物质的分离提纯、氧化还原反应、平衡移动原理等,题目难度中等,注意对溶解度数据的分析运用,理解复分解反应本质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 上述反应均为氧化还原反应 | |
| B. | 反应①、②中氧化剂都是氧气 | |
| C. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| D. | 钢铁在潮湿的空气中通常发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 101kPa时,2H2(g)+O2(g)═2H2O(g);△H=-QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-1 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| C. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)$?_{500℃,30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).
亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).| 化学键 | N=O | Cl-Cl | Cl-N | N-O |
| 键能/(kJ•mol-1) | 630 | 243 | a | 607 |
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
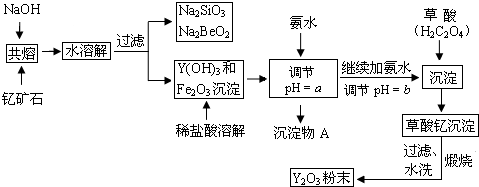
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 解释或结论 |
| A | Fe(OH )3 胶体通电后 | 阴极区红褐色加深 | Fe(OH)3胶体带正电 |
| B | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3 氧化,形成致密的氧化膜 |
| C | 将过量的过氧化钠投入 滴有酚酞试液的水中 | 最终得红色溶液 | 过氧化钠与水反应生成碱性物质 |
| D | 将镁粉和铝粉的混合物加 入过量的烧碱溶液中 | 仍有未溶解粉末 | 铝粉能与烧碱溶液反应,而镁粉不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氢碘酸加到Fe(OH)3胶体中 Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 以惰性电极电解MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+2OH-+Cl2↑ | |
| C. | 碳酸氢钙溶液中加少量烧碱 Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| D. | 向酸性FeSO4溶液中加H2O2溶液 2Fe2++H2O2+2H+═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类物质都有甜味,有甜味的物质都是糖类物质 | |
| B. | 蛋白质水解产物氨基酸可以合成人体所需蛋白质 | |
| C. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| D. | 食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com