
有科学家提出酸度新概念(AG),已知![]() ,下列有关推断一定正确的是( )
,下列有关推断一定正确的是( )
A.若pH<7,AG<0,则溶液一定呈酸性 B.若溶液呈碱性,则pH>7,AG>0
C.若溶液呈中性,则pH=7,AG=0 D.任何水溶液中都存在AG=-2pH-lgKw
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
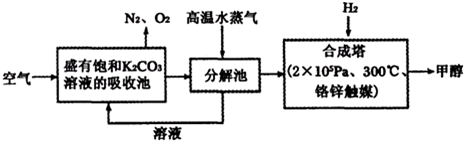
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.2 | 0.4 |
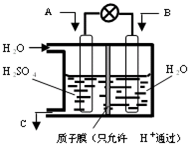
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) | c(OH-) |
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
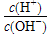 。25 ℃时,现有物质的量浓度为0.4 mol·L-1的HA溶液与0.2 mol·L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和)。
。25 ℃时,现有物质的量浓度为0.4 mol·L-1的HA溶液与0.2 mol·L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和)。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com