
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
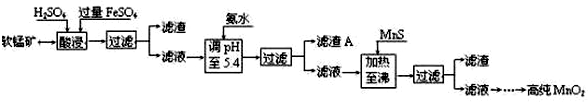
分析 (1)根据FeSO4在反应条件下将MnO2还原为MnSO4,则Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成;
(2)由题目信息可知,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH进行判断;
(3)根据工艺流程及硫化物的Ksp判断;
(4)由碱性锌锰干电池的电池反应式可知,Zn作负极,MnO2得电子作正极,生成MnOOH,由电荷守恒可知还生成OH-,由元素守恒可知,还有水参与反应;
(5)从碱性锌锰干电池的原料判断.
解答 解:(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应的化学方程式为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水调pH至5.4,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣A的主要成分为:Fe(OH)3和Al(OH)3,
故答案为:Fe(OH)3和Al(OH)3;
(3)根据题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+,
故答案为:Cu2+、Zn2+;
(4)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子,其电极反应式应为:MnO2+H2O+e-=MnOOH+OH-,
故答案为:MnO2+H2O+e-=MnOOH+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-);
(5)从碱性锌锰干电池的原料可知,其废旧电池可回收利用的物质为锌和MnO2,
故答案为:锌、二氧化锰.
点评 本题考查学生对元素及其化合物的主要性质的掌握、书写电极反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,题目难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力,明确实验原理及实验目的为解答关键,试题培养了学生的分析能力及化学实验能力.


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
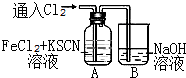 甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,发现A中溶液先呈红色后逐渐变为黄色.
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,发现A中溶液先呈红色后逐渐变为黄色.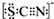 .则碳元素的化合价是+4
.则碳元素的化合价是+4查看答案和解析>>
科目:高中化学 来源: 题型:填空题
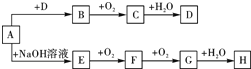 A~H等8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题:
A~H等8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为4NA | |
| B. | 氯碱工业中,当阴极产生标准状况下的气体22.4L时,电路中转移的电子数为2NA | |
| C. | 标准状况下,0.1mol苯中含有的σ键的数目为0.6NA | |
| D. | 配制200ml0.1mol/L的稀硫酸,需要98%的浓硫酸0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与水反应制乙醇、乙醇与氧气反应制乙醛都属于加成反应 | |
| B. | 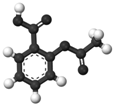 图为阿司匹林的球棍模型,其分子式是C9H8O4 | |
| C. | CH≡CH通过加聚反应可以得到结构片段为“…-CH=CH-CH=CH-…”的高分子化合物 | |
| D. | 往蛋白质溶液中加入饱和(NH4)2SO4溶液、CuSO4溶液都能产生沉淀,其原理不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO═2Fe+3CO2 | B. | Ca(OH)2+CO2═CaCO3↓+H2O | ||
| C. | CuO+H2═Cu+H2O | D. | 2Na+Cl2═2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com