

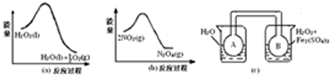
分析 (1)根据图示装置及药品进行判断;氨气极易溶于水,生成的氨气不会全部逸出;
(2)装置B作用是干燥生成的氨气,应该选用碱石灰;装置C用于稀释氨气,可以使用不具有挥发性的稀硫酸;
(3)根据洗气瓶装置的质量为氨气的质量计算出莫尔盐的物质的量及质量,再计算出莫尔盐的纯度.
解答 解:(1)从图1药品为莫尔盐和氢氧化钠,说明甲同学想通过测定生成氨气的体积计算摩尔盐的纯度;由于氨气极易溶于水,所以溶液中一定含有部分氨气没有逸出,
故答案为:生成氨气的体积;氨气有一部分会溶解在溶液中;
(2)根据图2可知,装置B为干燥装置,干燥氨气可以使用碱石灰;氨气极易溶于水,吸收时需要防止倒吸,使用C中干燥管的作用是防止倒吸,
故答案为:碱石灰;防止倒吸;
(3)乙同学称取了10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重O.68g,增重部分为氨气的质量,生成的氨气的物质的量为:$\frac{0.68g}{17g/mol}$=0.04mol,10.0g的摩尔盐样品中含有莫尔盐的物质的量为:0.02mol,所以这份摩尔盐的纯度为:$\frac{392g/mol×0.02mol}{10g}$×100%=78.4%,
故答案为:78.4.
点评 本题考查了探究物质组成、测定物质的含量的方法,题目难度中等,注意掌握探究物质组成、测定物质含量的方法,解题关键是明确实验原理.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mo1•L-1的NaAlO2 水溶液中含有的氧原子数为2 NA | |
| B. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2 NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为0.2 NA | |
| D. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的化学式为:K2O2 | B. | KNO3发生氧化反应 | ||
| C. | NaN3的电子式为 | D. | 氧化产物与还原产物质量比为1:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的活泼顺序为:a>c>b>d | |
| B. | 在①的溶液中,SO42-向b极移动 | |
| C. | 在③的装置中,一段时间后b电极质量将会减轻 | |
| D. | 二次电池放电时的反应和充电时的反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
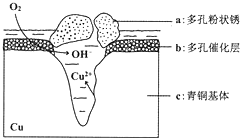 如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )| A. | 腐蚀过程中,铜被氧化 | |
| B. | 已知环境中的 Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,则其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 4.29 g Cu2(OH)3Cl,则理论上耗氧体积定为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂及操作 |
| A | 氢氧化钠 | 硫酸钠 | 加入适量氢氧化钙,过滤 |
| B | 生石灰 | 碳酸钙 | 高温锻烧 |
| C | 二氧化碳 | 一氧化碳 | 通过有足量灼烧氧化铁的玻璃管 |
| D | 氧化铜粉末 | 木炭粉 | 隔绝空气加强热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com