
分析 (1)反应生成氯气和氯化锰,以此判断盐酸的性质;
(2)反应中Cl元素化合价由-1价升高到0价,以此判断生成的氯气的体积;
(3)配制该KMnO4溶液时需要托盘天平(带砝码)、药匙、烧杯、玻璃棒、量筒、100mL容量瓶、胶头滴管;结合n=$\frac{m}{M}$=cV计算.
解答 解:(1)HCl反应生成KCl、MnCl2和Cl2,反应中盐酸表现为酸性和还原性,故答案为:③;
(2)Cl元素化合价由-1价升高到0价,由方程式可知,当生成5mol氯气时,转移10mol电子,如反应中转移了0.3mol电子,则产生0.15mol气体,体积为为0.15mol×22.4L/mol=3.36L,故答案为:3.36;
(3)①配制该KMnO4溶液时需要托盘天平(带砝码)、药匙、烧杯、玻璃棒、量筒,还需要50mL容量瓶、胶头滴管,故答案为:50mL容量瓶;
②n(KMnO4)=0.05L×1.5mol/L=0.075mol,
m(KMnO4)=0.075mol×158g/mol=11.9g,
故答案为:11.9.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NO2、SO2、BF2、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| C. | NaCl晶体中与每个Na+距离相等且最近的Na+共有8个 | |
| D. | 单质的晶体中一定不存在的微粒是阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 用铜作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 氯化钠与浓硫酸混合加热:H2SO4+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:
(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. ②
②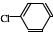 中氯原子较难水解物质A(
中氯原子较难水解物质A(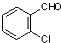 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式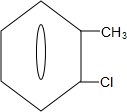 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$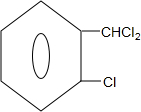 +2HCl;
+2HCl; +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$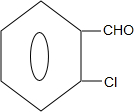 +2NaCl+2H2O
+2NaCl+2H2O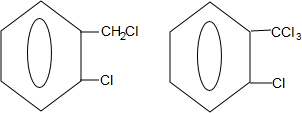
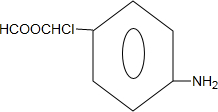
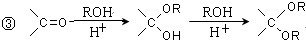
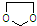 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$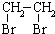
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | KCIO3(g) | 催化剂 | 产生气体(mL) (已折算到标准情况) | 耗时(S) | ||
| 化学式 | 质量(g) | 回收 | ||||
| ① | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| ② | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| ③ | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| ④ | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
| 提出猜想 | 该刺激性气味的气体单质可能是Cl2 |
| 设计实验 验证猜想 | 实验步骤和结论(不要求写具体操作过程)将燃着的小木条插进集气瓶中,直至木条熄灭,用玻璃棒粘着湿润的碘化钾淀粉试纸插进集气瓶中.若试纸变蓝则证明是Cl2,否则不是氯气: |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCl的电子式H:Cl | B. | HClO的结构式H-Cl-O | ||
| C. | Cl-的结构示意图 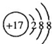 | D. | 质量数为37的氯原子${\;}_{17}^{37}Cl$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com