
���� ��1�������ǻ���Na��Ӧ�����������������ʵ�����ȣ�����ԭ���غ��֪���������к����ǻ���ĿԽ�࣬��������Խ�ࣻ
��2��������������ȣ��ǻ���������Խ����������Խ�ࣻ
��3������ͨʽ��ʾΪCxHyOz��1mol���ĺ�����Ϊ��x+$\frac{y}{4}$-$\frac{z}{2}$�����ݴ˼����жϣ�
��4��������������ȣ���̼ԭ���غ㣬CԪ����������Խ�����ɶ�����̼Խ�࣮
��� �⣺��1�������ǻ���Na��Ӧ�����������ټ״������Ҵ������Ҷ������ܱ��������������ǻ���Ŀ�ֱ�Ϊ1��1��2��3���������ʵ�����ȣ�����ԭ���غ��֪���������к����ǻ���ĿԽ�࣬��������Խ�࣬����������Ϊ���ܣ��ۣ���=�ڣ�
�ʴ�Ϊ���ܣ��ۣ���=�ڣ�
��2���ټ״������Ҵ������Ҷ������ܱ������У��ǻ�������ӵ�����֮��Ϊ16��32��16��46��16��31��16��$\frac{92}{3}$��16��30.7��������������ȣ��ǻ���������Խ����������Խ�࣬�������������ܣ��ۣ��٣��ڣ�
�ʴ�Ϊ���ܣ��ۣ��٣��ڣ�
��3����1mol�״�������Ϊ��1+$\frac{4}{4}$-$\frac{1}{2}$��mol=1.5mol����1mol�Ҵ�������Ϊ��2+$\frac{6}{4}$-$\frac{1}{2}$��mol=3mol����1mol�Ҷ���������Ϊ��2+$\frac{6}{4}$-$\frac{2}{2}$��mol=2.5mol����1mol������������Ϊ��3+$\frac{8}{4}$-$\frac{3}{2}$��mol=3.5mol���ʸ���������Ϊ���ܣ��ڣ��ۣ��٣�
�ʴ�Ϊ���ܣ��ڣ��ۣ��٣�
��4��������������ȣ���̼ԭ���غ㣬CԪ����������Խ�����ɶ�����̼Խ�࣬�ټ״������Ҵ������Ҷ������ܱ������У�̼Ԫ��������ӵ�����֮��Ϊ12��32��12��23��12��31��12��$\frac{92}{3}$��12��30.7�������ɶ�����̼Ϊ���ڣ��ܣ��ۣ��٣�
�ʴ�Ϊ���ڣ��ܣ��ۣ��٣�
���� ���⿼���л���ȼ���йؼ��㣬ע������ȼ��ͨʽ�����йع��ɣ��ϺõĿ���ѧ������������ܽ��������Ѷ��еȣ�


 ���ſ����ϵ�д�
���ſ����ϵ�д� ���Ŀ����ϵ�д�
���Ŀ����ϵ�д� ������ӱ������ͯ������ϵ�д�
������ӱ������ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��ԭ�ԣ�HF��HCl��HBr��HI | B�� | �ȶ��ԣ�HF��HCl��HBr��HI | ||
| C�� | �����ԣ�F2��Cl2��Br2��I2 | D�� | �е㣺Cl2��F2��Br2��I2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+��H+��Cu2+��NO3- | B�� | Na+��Fe2+��H+��NO3- | ||
| C�� | NH4+��Cl-��SO42-��OH- | D�� | HCO3-��I-��Na+��OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���Ը������ | B�� | ��ˮ | C�� | Һ�� | D�� | NaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
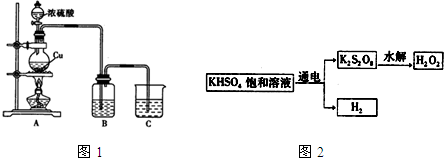
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �輰�仯����Ŀ��������Ѿã����ִ��������й㷺Ӧ�ã��ش��������⣮
�輰�仯����Ŀ��������Ѿã����ִ��������й㷺Ӧ�ã��ش��������⣮| ��������Ҫ��Ӧ | |
| �绡¯ | SiO2+2C$\frac{\underline{\;1600-1800��\;}}{\;}$Si+2CO�� |
| ��������Ӧ�� | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| ��ԭ¯ |
| ���� | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| �е�/��C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮ���𱽡��Ҵ������Ȼ�̼ | |
| B�� | ȷ��ȡ4.0 gNaOH����9 6 mLˮ����������Ϊ4.0%����Һ | |
| C�� | Ϊ��ȥ���е��������ӣ��������м�����������ˮ����� | |
| D�� | �ü���ʼ��������Һ�Ķ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 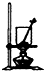 ���������ճɻ� | B�� | 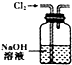 ��ȥ�����е�HCl | C�� |  ʵ������ȡNO | D�� | 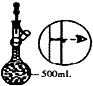 ������Һ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com